| Металл | h=a +b lg i a,B b,B | lg io, A/см2 | ap | ||
| Pt | 0,30 | 0,140 | -2,14 | 0,42 | |
| W | 0,23 | 0,040 | -5,75 | 1,48 | |
| Pd | 0,24 | 0,030 | -8,00 | 1,97 | |
| Со | 0,62 | 0,140 | -4,43 | 0,42 | |
| Ni | 0,63 | 0,110 | -5,72 | 0,54 | |
| Ag | 0,95 | 0,116 | -8,20 | 0,51 | |
| Сu | 0,80 | 0,115 | -6,95 | 0,52 | |
| Sn | 1,24 | 0,116 | -10,07 | 0,51 | |
| Zn | 1,24 | 0,118 | -10,05 | 0,50 | |
| Cd | 1,40 | 0,126 | -11,11 | 0,47 | |
| Hg | 1,45 | 0,113 | -12,30 | 0,52 | |
| Pb | 1,56 | 0,110 | -14,20 | 0,54 | |
| Tl | 1,55 | 0,140 | -11,07 | 0,52 | |
Видно, что для большинства металлов значения коэффициента переноса близки к 0,5. Величины же тока обмена изменяются от 7,2×10-3 А/см2 для платинового катода до 6,3×10-15 А/см2 для свинцового. Значения i и a для конкретных электрохимических реакций приводятся в справочной литературе.
Отметим, что электрохимическая поляризация значительна по величине (при малых значениях тока обмена) и постоянно растет с увеличением тока. Ее негативная роль проявляется в дополнительных энергетических затратах на процесс электролиза, притом затратах существенных.
С другой стороны, большое перенапряжение выделения водорода на ряде электроотрицательных металлов позволяет выделять их из водных растворов с большими выходами по току. Так, например, стандартный потенциал системы
Pb2+/Pb равен -0,126 В и из водных растворов солей свинца, согласно термодинамике, в первую очередь и преимущественно должен выделяться водород (Е°н+/н2 = 0,000 В). Однако в условиях электролиза последовательность выделения элементов определяется не только величиной равновесного потенциала, но и величиной поляризации электродов, а она существенно различна для конкурирующих реакций:
-hн2(рb)= 1,56+0,11 lgi, (2.19)
- hPb(Pb) = 0,08 + 0,046 lg i. (2.20)
В результате при электролизе потенциалы этих двух конкурирующих реакций сравниваются уже при очень малых значениях плотности тока, которую находим из условия равенства потенциалов рассматриваемых систем под током:
Ео Рb2+ /Рb +hPb(Pb) = ЕoH+/Н 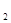 +hН
+hН 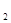 (Рb)
(Рb)
-0,126 - 0,08 - 0,046 Igi = 0 - 1,56 - 0,1 llgi
0,0641gi==-1,354; lgi=-21,2.
Таким образом, уже при плотности тока 6,3×10-22 А/см2 потенциалы выделения свинца и водорода сравниваются. При реальных же плотностях (0,01 А/см2) практически весь ток будет расходоваться на осаждение свинца. Действительно, потенциал свинцового электрода при i = 0,01 А/см2 равен ЕoРb2+ /Рb +h = -0,126-0,08-0,046lgi =-0,126-0,08 + 0,92 =-0,114 В. Такой потенциал отвечает скорости разряда ионов водорода (iн) на свинцовом катоде, рассчитываемой по соотношению: -0,114 = 0-1,56-0,11 lgiн;
lgiн = -1,446/0,11 = -13,15, iн = 7,1×10-14 А/см2.
Видно, что iн<i, и выход свинца по току будет близок к 100%, хотя его стандартный потенциал существенно отрицательнее потенциала водородного электрода.
Большое перенапряжение выделения водорода из водных растворов, обусловленное малыми значениями токов обмена, позволяет успешно выделять из водных растворов электроотрицательные металлы, вплоть до цинка (EоZn2+/Zn = -0,762 В).
Наряду с электрохимической поляризацией важную роль играет концентрационная поляризация.
 2015-05-22
2015-05-22 727
727








