ЛП необходимы для транспорта и метаболизма липидов. ЛП — различные по плотности частицы, разделяющиеся при ультрацентрифугировании на отдельные фракции, что лежит в основе их классификации. Поверхностные слои ЛП состоят из нескольких типов аполипопротеинов (табл. 2-3), свободного ХС и фосфолипидов. Внутренняя часть ЛП представлена эфирами ХС, ТГ и жирорастворимыми витаминами.
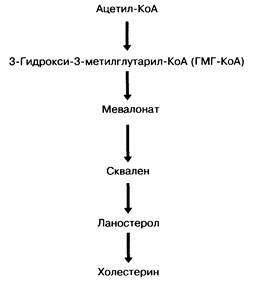
Рис. 2-6. Биосинтез холестерина.
Таблица 2-3. Свойства липопротеинов
| Липопротеины | Аполипопротеины | Место образования | Переносчик |
| Хиломикроны | В-48.АI, C-II, Е | Кишечник | Жиров, поступающих с пищей |
| ЛПОНП | В-100, C-II, Е | Печень | Печёночных триглицеридов и холестерина |
| ЛПНП | В-100 | Образуются из ЛПОНП | ХС |
| ЛПВП | А-1,А-II | Ткани | Эфиров ХС |
Существует несколько путей метаболизм а ЛП, среди которых ведущая роль принадлежит двум. Первый из них участвует в трансформации жиров, абсорбированных в кишечнике, а второй — в переработке эндогенных липидов (рис. 2-7). ^и пути имеют общие звенья.
Пищевые жиры всасываются в гонкой кишке и включаются в состав хиломикронов. Последние проникают в кровоток (через грудной лимфатический проток), где ТГ удаляются при участии фермента липопротеинлипазы. ТГ утилизируются или накапливаются в тканях. Остатки хиломикронов захватываются печенью, а ХС метаболизируется, включается в состав плазматических мембран либо выводится с жёлчью.
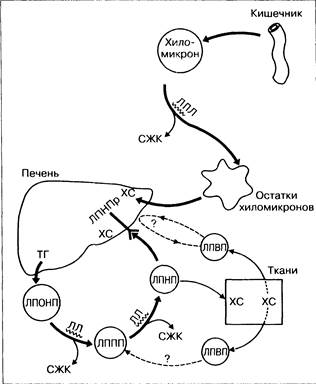
Рис. 2-7. Роль печени и метаболизме липопротеинов. ЛПЛ — липопротеинлипаза, СЖК — свободные жирные кислоты, ХС — холестерин, ТГ — триглицериды, ЛПНПр — рецепторы ЛПНП (классификация ЛП приведена в табл. 2-3).
При втором пути метаболизма триглицериды включаются в образуемые в печени липопротеины очень низкой плотности (ЛПОНП), В крови под действием липопротеинлипазы триглицериды отщепляются от ЛПОНП. При этом частицы ЛПОНП уменьшаются в размерах и образуют ЛП промежуточной плотности (ЛППП), а затем — ЛП низкой плотности (ЛПНП), являющиеся основными переносчиками ХС. ЛПНП преимущественно удаляются посредством специфических рецепторов на поверхности гепатоцитов. На других клетках также имеются подобные рецепторы, играющие важную роль в образовании атеросклеротических бляшек.
ЛП высокой плотности (ЛПВП) ускоряют удаление ХС из тканей. ХС, содержащийся в ЛПВП, захватывается печенью либо включается в состав ЛППП, приводя к образованию зрелых ЛПНП. Удаление ХС из тканей посредством ЛПВП играет важную роль. Высокий уровень ХС ЛПВП в крови предотвращает развитие ишемической болезни сердца. Пути метаболизма ЛПВП пока не установлены.
Большинство аполипопротеинов образуется в печени, часть из них синтезируется также в кишечнике. Некоторые аполипопротеины, будучи структурным компонентом ЛП, вы полня ют также и другие функции: апо A-I активирует ЛХАТ в плазме, С-II активирует липопротеинлипазу.
Метаболизм липидов при болезнях печени [1]
Холестаз. При холестазе повышается уровень общего и свободного ХС в сыворотке. Механизм этого повышения неизвестен. Тем не менее это не просто следствие задержки ХС, в норме выделяемого с жёлчью. По-видимому, в повышении уровня холестерина в сыворотке участвуют 4 фактора: заброс ХС из жёлчи в кровоток, повышение образования ХС в печени, снижение активности ЛХАТ, регургитация содержащегося в жёлчи лецитина, что способствует переходу в плазму тканевого холестерина. В то время как при остром холестазе иногда отмечается незначительное (в 1,5—2 раза) повышение уровня ХС, при хронических заболеваниях, особенно при послеоперационных стриктурах и первичном билиарном циррозе, этот показатель достигает очень больших значений. При пятикратном повышении уровня ХС в сыворотке отмечается появление кожных ксантом. Недостаточное питание приводит к снижению уровня ХС в сыворотке, что объясняет нормальное содержание ХС у части больных с механической обструкцией жёлчных путей злокачественной опухолью.
Содержание эфиров ХС при холестазе снижается вследствие дефицита ЛХАТ. Уровень ТГ повышается. В сыворотке выявляется аномальный липопротеин X, который содержит большое количество свободного ХС и лецитина и при электронно-микроскопическом исследовании имеет вид двухслойных дисков. Изменения эритроцитов при холестазе связаны с нарушением содержания ХС и ЛП.
Печёночно-клеточное поражение. При повреждении гепатоцитов уровень ТГ в сыворотке повышается в связи с накоплением ЛПНП, которые богаты ТГ. Концентрация эфиров ХС снижена вследствие низкой активности фермента ЛХАТ. При циррозе печени уровень общего ХС в сыворотке обычно нормальный. Его снижение свидетельствует о нарушении питания или декомпенсации цирроза. При жировой печени алкогольной этиологии наряду с увеличением содержания ТГ повышается уровень ЛПОНП. При поражении печени гепатотоксичными препаратами нарушение синтеза апопротеинов приводит к нарушению выведения ТГ с ЛПОНП и развитию в последующем жировой печени.
Анализ крови на содержание в сыворотке эфиров ХС, ЛП, липопротеина Х и активность ЛХАТ при обычном обследовании не выполняют. Эти показатели не играют существенной роли в диагностике или оценке функции печени, хотя низкая активность ЛХАТ в раннем периоде после трансплантации печени может свидетельствовать о нарушении функции трансплантата [2].
Жёлчные кислоты
Жёлчные кислоты (ЖК) образуются исключительно в печени. Ежедневно 250—500 мг ЖК синтезируется и теряется с калом. Синтез ЖК регулируется по механизму отрицательной обратной связи. Из ХС синтезируются первичные ЖК: холевая и хенодезоксихолевая (рис. 2-8). Синтез регулируется количеством ЖК, которые возвращаются в печень в процессе энтерогепатической циркуляции. Под действием бактерий кишечника первичные ЖК подвергаются 7а-дегидроксилированию с образованием вторичных ЖК: дезоксихолевой и очень незначительного количества литохолевой. Третичные ЖК, в основном урсодезоксихолевая, образуются в печени путём изомеризации вторичных ЖК. В жёлчи человека количество тригидроксикислоты (холевой кислоты) приблизительно равно сумме концентраций двухдигидроксикислот — хенодезоксихолевой и дезоксихолевой.
ЖК соединяются в печени с аминокислотами глицином или таурином. Это предотвращает их всасывание в жёлчных путях и тонкой кишке, однако не предотвращает всасывания в терминальном отделе подвздошной кишки. Сульфатирование и глюкуронирование (являющиеся детоксикационными механизмами) могут усиливаться при циррозе или холестазе, при которых в моче и жёлчи обнаруживают избыток этих конъюгатов [11]. Бактерии могут гидролизовать соли ЖК на ЖК и глицин или таурин.
Соли ЖК экскретируются в жёлчные канальцы против большого градиента концентрации между гепатоцитами и жёлчью. Экскреция частично зависит от величины внутриклеточного отрицательного потенциала, который приблизительно равен 35 мВ и обеспечивает потенциалзависимую ускоренную диффузию, а также от опосредованного переносчиком (гликопротеином с молекулярной массой 100 кДа) процесса диффузии [7, 9]. Соли ЖК проникают в мицеллы и пузырьки, соединяясь с ХС и фосфолипидами. В верхних отделах тонкой кишки мицеллы солей ЖК, довольно крупные по размеру, обладают гидрофильными свойствами, что препятствует их абсорбции. Они участвуют в переваривании и всасывании липидов. В терминальном отделе подвздошной кишки и проксимальной части толстой кишки происходит всасывание ЖК, причём в подвздошной кишке всасывание происходит путём активного транспорта. Пассивная диффузия неионизированных ЖК происходит на всём протяжении кишечника и является наиболее эффективной в отношении неконъюгированных дигидрокси-ЖК. Пероральный приём урсодезоксихолевой кислоты нарушает всасывание
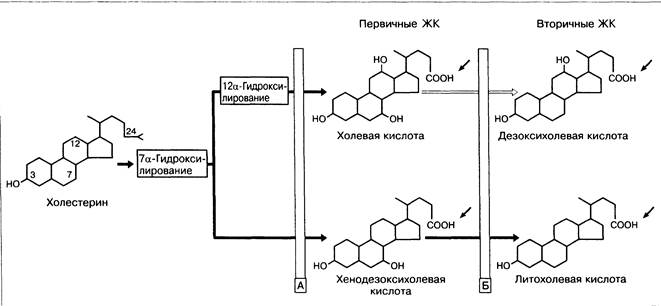
Рис. 2-8. Синтез первичных и вторичных ЖК из холестерина. А — расщепление боковой цепи (участка протяжённостью от С27 стероида до С24 карбоксильной кислоты) путём окисления; Б — 7а-дегидроксилирование кишечными бактериями (стрелки указывают место конъюгации с глицином или таурином).
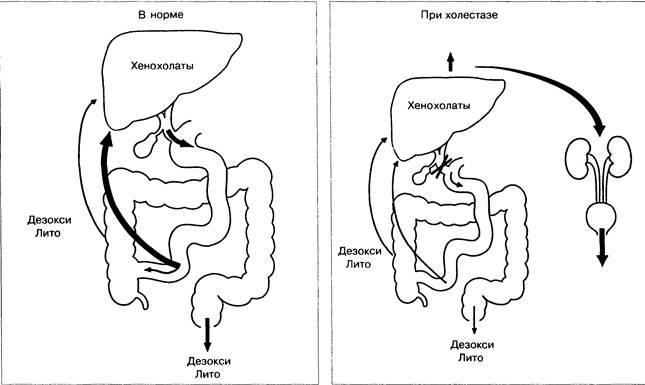
Рис. 2-9. Энтерогепатическая циркуляция ЖК в норме и при холестазе.
хенодезоксихолевой и холевой кислот в тонкой кишке [10].
Абсорбированные соли ЖК попадают в систему воротной вены и в печень, где интенсивно захватываются гепатоцитами. Этот процесс происходит благодаря функционированию содружественной системы транспорта молекул через синусоидальную мембрану, основанной на градиенте Na+. В этом процессе участвуют также ионы С1–. Наиболее гидрофобные ЖК (несвязанные моно- и дигидрокси жёлчные кислоты), вероятно, проникают в гепатоцит путём простой диффузии (по механизму «флип-флоп») через липидную мембрану. Остаётся неясным механизм транспорта Ж К через гепатоцит от синусоидов к жёлчным канальцам. В этом процессе участвуют связывающие ЖК цитоплазматические белки, например За-гидроксистероиддегидрогеназа [12]. Роль микротрубочек неизвестна. Везикулы участвуют в переносе ЖК лишь при высокой концентрации последних [2[. ЖК повторно конъюгируются и вновь выделяются в жёлчь. Литохолевая кислота повторно не экскретируется.
Описанная энтерогепатическая циркуляция ЖК происходит от 2 до 15 раз в сутки (рис. 2-9). Абсорбционная способность различных ЖК, как и скорость их синтеза и обмена, неодинакова.
При холестазе ЖК экскретируются с мочой путём активного транспорта и пассивной диффузии. ЖК сульфатируются, образующиеся конъюгаты активно секретируются почечными канальцами [13].
 2015-06-10
2015-06-10 3497
3497








