1. Уравнение 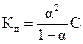 называется законом:
называется законом:
1) выпаривания Оствальда
2) отведения Оствальда
3) разведения Оствальда
4) смешивания Оствальда
2. Константе диссоциации слабого электролита (если 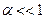 ) соответствует уравнение:
) соответствует уравнение:
1) 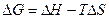
2) 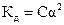
3) 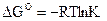
4) 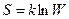
3. Гидратная теория электролитической диссоциации была предложена:
1) С. Аррениусом
2) Д.И.Менделеевым
3) О.Генри
4) Г. Льюис
4. Электролитическая диссоциация сопровождается:
1) увеличением энтропии и уменьшением энергии Гиббса
2) увеличением энтропии и увеличением энергии Гиббса
3) уменьшением энтропии и увеличением энергии Гиббса
4) энтропия и энергия Гиббса не изменяется
5. Степень диссоциации в растворах слабых электролитов – это отношение:
1) количества молекул продиссоциированных к общему количеству молекул вещества
2) общего количества молекул вещества к количеству, продиссоциированных молекул
3) активной концентрации вещества к общей концентрации вещества в растворе
4) общей концентрации вещества в растворе к активной концентрации вещества
6. Чем больше концентрация электролита, степень диссоциации:
1) увеличивается
2) уменьшается
3) не зависит от концентрации
4) вначале увеличивается, затем уменьшается
7. Взаимосвязь константы и степени диссоциации слабого электролита описывается законом:
1) Гульдберга-Вааге
2) В.Оствальда
3) М.К.Сеченова
4) О.Генри
8. Константа диссоциации слабого электролита не зависит от:
1) природа электролита
2) полярности растворителя
3) температуры
4) концентрации вещества
9. Коэффициент активности иона тем больше, чем:
1) больше концентрация электролита
2) меньше концентрация электролита
3) меньше растворимость электролита
4) не зависит от концентрации электролита
10. Ионная сила раствора – это:
1) произведение концентрации иона на квадрат его заряда
2) произведение концентрации иона на его заряд
3) сумма произведения концентрации ионов на квадрат их зарядов
4) полусумма произведения концентрации ионов на квадрат их зарядов
11. Коэффициент активности ионов (fi) в очень разбавленных растворах равен:
1) 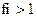
2) 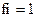
3) 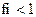
4) 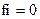
12. Математическое выражение коэффициента активности 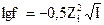 - это уравнение:
- это уравнение:
1) Галлера
2) Смолуховского
3) Дебая-Хюккеля
4) Генри
13. Физиологический раствор – это:
1) 1% раствор карбоната натрия
2) 1% раствор хлорида натрия
3) 0,9% раствор карбоната натрия
4) 0,9% раствор хлорида натрия
14. Ионная сила плазмы крови человека равна:
1) 0,25 м
2) 0,15 м
3) 0,9 м
4) 0,3 м
15. рН раствора одноосновной кислоты равен 1, это кислота:
1) сильная
2) слабая
3) средней силы
4) очень слабая
16. Смешивают равные объемы растворов 0,5 м HCI и 0,4 м KOH, рН полученного раствора равен:
1) 2
2) 1
3) -1
4) -2
17. Если 1 л раствора содержит 0,1 моль NaOH, то рН раствора равен:
1) 1,3
2) 13
3) 3,1
4) 12
18. Для вычисления рН раствора сильного основания используют:
1) Н+=Сн+
2) ОН-=Сон-
3) рН=14+lg[ОН-]
4) рН=1/2рКосн
Ответы
| Вариант 2 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
 2015-06-14
2015-06-14 712
712








