1. Физико-химическая теория растворов создана:
2) Д.И.Менделеевым и И.А.Каблуковым
3) Дальтоном
4) О.Генри
5) Г.Льисом
2. Электролитическая диссоциация сопровождается:
1) уменьшением энергии Гиббса, 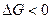
2) увеличением энергии Гиббса, 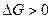
3) вначале уменьшением, затем увеличением энергии Гиббса
4) энергия Гиббса не изменяется
3. Электролит, при диссоциации, по первой ступени, которого образуются только ионы ОН-:
1) (CuOH)2CO3
2) MgOHCl
3) KOH
4) HCl
4. Чем меньше концентрация электролита, тем:
1) больше степень диссоциации
2) меньше степень диссоциации
3) константа диссоциации увеличивается
4) степень диссоциации не зависит от концентрации
5. Степень диссоциации слабого электролита, уменьшается при:
1) при добавлении одноименного иона
2) увеличением температуры
3) разбавлении
4) увеличении давления
6. Уравнение 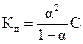 называется законом:
называется законом:
1) выпаривания Оствальда
2) отведения Оствальда
3) разведения Оствальда
4) смешивания Оствальда
7. Константе диссоциации слабого электролита (если 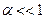 ) соответствует уравнение:
) соответствует уравнение:
1) 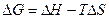
2) 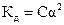
3) 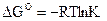
4) 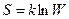
8. При диссоциации одной формульной единицы соли (дихромата калия) число образующихся ионов равно:
1) 3
2) 5
3) 6
4) 4
9. Степень диссоциации уксусной кислоты больше в растворе:
1) 0,2 м
2) 0,02 м
3) 0,002 м
4) 0,0002 м
10. Степень диссоциации слабого электролита увеличивается при:
1) добавлении одноименного иона
2) увеличении концентрации раствора
3) разведении раствора
4) охлаждении раствора
11. Взаимосвязь константы диссоциации и степени диссоциации слабого электролита описывается законом:
1) Гульдберга-Вааге
2) В.Оствальда
3) М.К.Сеченова
4) О.Генри
12. Константа диссоциации слабого электролита не зависит от:
1) природа электролита
2) полярности растворителя
3) температуры
4) концентрации вещества
13. Концентрация иона SO42- в 0,01 м растворе соли Al2(SO4)3:
1) 0,01 м
2) 0,02 м
3) 0,03 м
4) 0,05 м
14. С увеличением ионной силы раствора коэффициент активности иона в уравнении 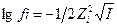 :
:
1) уменьшается
2) увеличивается
3) не изменяется
4) в начале увеличивается, затем остается постоянным
15. Ионная сила плазмы крови человека равна:
1) 0,25 м
2) 0,15 м
3) 0,9 м
4) 0,3 м
16. рОН раствора – это:
1) – ln [OH-]
2) – lg [OH-]
3) + ln [OH-]
4) + lg [OH-]
17. Для вычисления рН раствора слабой кислоты используют уравнение:
1) 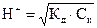
2) 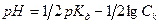
3) 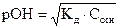
4) 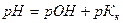
18. Больному внутримышечно ввели 8 мл 2% раствора лекарственного препарата, Сколько мг препарата введено больному:
1) 20
2) 40
3) 160
4) 100
Ответы
| Вариант 3 | ||||||||||||||||||
 2015-06-14
2015-06-14 730
730








