Образцы Тестов.
Растворы. Шкала рН
Вариант 1
Часть А
1. Взаимосвязь константы диссоциации и степени диссоциации слабого электролита описывается законом:
1) Гульдберга-Вааге
2) В.Оствальда
3) М.К.Сеченова
4) О.Генри
2. Константа диссоциации слабого электролита не зависит от:
1) природа электролита
2) полярности растворителя
3) температуры
4) концентрации вещества
3. Коэффициент активности иона тем больше, чем:
1) больше концентрация электролита
2) меньше концентрация электролита
3) меньше растворимость электролитат
4) не зависит от концентрации электролита
4. Только слабые электролиты перечислены в ряду:
1) NH4OH, H2S, H2SO3
2) H2CO3, NaCl, CH3COOH
3) HClO, KOH, MgSO4
4) CaCl2, H2Te, HI
5. Электролитом не является:
1) расплав КОН
2) азотная кислота
3) раствор NaOH
4) этиловый спирт
6. Электролитическая диссоциация сопровождается:
1) уменьшением энергии Гиббса, 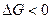
2) увеличением энергии Гиббса, 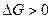
3) вначале уменьшением, затем увеличением энергии Гиббса
4) энергия Гиббса не изменяется
7. Количественной характеристикой процесса электролитической диссоциации электролита является:
1) степень диссоциации
2) константа растворимости
3) степень ионизации
4) константа эбуллиоскопическая
8. Степень диссоциации уксусной кислоты больше в растворе:
1) 0,2 м
2) 0,02 м
3) 0,002 м
4) 0,0002 м
9. Степень диссоциации слабого электролита увеличивается при:
1) добавлении одноименного иона
2) увеличении концентрации раствора
3) разведении раствора
4) охлаждении раствора
10. В водном растворе из каждых 100 молекул образуется 100 катионов водорода для кислот:
1) Угольной
2) Азотной
3) Фосфорной
4) Азотистой
11. Константа диссоциации слабого электролита не зависит от:
1) природа электролита
2) полярности растворителя
3) температуры
4) концентрации вещества
12. Коэффициент активности иона тем больше, чем:
1) больше концентрация электролита
2) меньше концентрация электролита
3) меньше растворимость электролита
4) не зависит от концентрации электролита
13. Ионная сила 0,1 М раствора сульфата алюминия равна:
1) 1,5
2) 0,5
3) 0,75
4) 3
14. Математическое выражение коэффициента активности 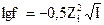 - это уравнение:
- это уравнение:
1) Галлера
2) Смолуховского
3) Дебая-Хюккеля
4) Генри
15. Коэффициент активности ионов (fi) в концентрированных растворах равен:
1) 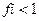
2) 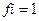
3) 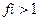
4) 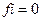
16. Физиологический раствор – это:
1) 1% раствор карбоната натрия
2) 1% раствор хлорида натрия
3) 0,9% раствор карбоната натрия
4) 0,9% раствор хлорида натрия
17. Для вычисления рН раствора слабой кислоты используют уравнение:
1) 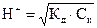
2) 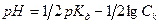
3) 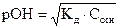
4) 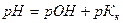
18. Смешивают равные объемы растворов 0,4 м HNO3 и 0,5 м KOH, рОН полученного раствора равен:
1) 2
2) 1
3) 4
4) -3
Ответы
| Вариант 1 | ||||||||||||||||||
 2015-06-14
2015-06-14 667
667







