1. Электролит, при диссоциации, по первой ступени, которого образуются только ионы ОН-:
1) (CuOH)2CO3
2) MgOHCl
3) KOH
4) HCl
2. Чем меньше концентрация электролита, тем степень диссоциации:
1) больше
2) меньше
3) степень диссоциации не зависит от концентрации
4) вначале уменьшается, затем увеличивается
3. Степень диссоциации слабого электролита, уменьшается при:
1) при добавлении одноименного иона
2) увеличением температуры
3) разбавлении
4) увеличении давления
4. Электрический ток не проводят водные растворы:
1) ацетата Na
2) хлорид метиламмония
3) муравьиной кислоты
4) глицерина
5. Количественной характеристикой процесса электролитической диссоциации электролита является:
1) степень диссоциации
3) степень ионизации
6. Степень диссоциации уксусной кислоты больше в растворе:
1) 0,2 м
2) 0,02 м
3) 0,002 м
4) 0,0002 м
7. Степень диссоциации слабого электролита увеличивается при:
1) добавлении одноименного иона
2) увеличении концентрации раствора
3) разведении раствора
4) охлаждении раствора
8. Взаимосвязь константы диссоциации и степени диссоциации слабого электролита описывается законом:
1) Гульдберга-Вааге
2) В.Оствальда
3) М.К.Сеченова
4) О.Генри
9. Константа диссоциации слабого электролита не зависит от:
1) природа электролита
2) полярности растворителя
3) температуры
4) концентрации вещества
10. Способность электролита диссоциировать на ионы характеризуется:
1) степенью диссоциации
2) константой растворимости
3) константой Генри
4) константой нестойкости
11. Степень диссоциации HCN меньше в растворе:
1) 0,1 м
2) 0,01 м
3) 0,001 м
4) 0,0001 м
12. Концентрация иона SO42- в 0,01 м растворе соли Al2(SO4)3:
1) 0,01 м
2) 0,02 м
3) 0,03 м
4) 0,05 м
13. С увеличением ионной силы раствора коэффициент активности иона в уравнении 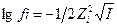 :
:
1) уменьшается
2) увеличивается
3) не изменяется
4) в начале увеличивается, затем остается постоянным
14. Ионная сила плазмы крови человека равна:
1) 0,25 м
2) 0,15 м
3) 0,9 м
4) 0,3 м
15. рОН раствора – это:
1) – ln [OH-]
2) – lg [OH-]
3) + ln [OH-]
4) + lg [OH-]
16. С увеличением диэлектрической проницаемости среды степень диссоциации:
1) уменьшается
2) увеличивается
3) не изменяется
4) вначале уменьшается, затем увеличивается
17. Смешивают равные объемы растворов 0,5 м HNO3 и 0,4 м KOH, рН полученного раствора равен:
1) 2
2) 1
3) -1
4) -2
18. При диссоциации одной формульной единицы соли (нитрита алюминия) число образующихся ионов равно,:
1) 5
2) 4
3) 6
4) 3
Ответы
| Вариант 5 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
 2015-06-14
2015-06-14 1086
1086








