Поверхность – граница раздела между двумя контактирующими средами
Поверхностные явления – совокупность явлений, обусловленные физико-химическими свойствами на границе между соприкасающимися веществами.
Т.е это те явления, которые происходят на поверхности, обусловленные поверхностной энергией.
Приповерхностные слои материала рассматриваются как подсистема общей системы деформируемого материала.
Удельная поверхность: Sуд = S/V
К поверхностным явлениям относятся:
1) поверхностное напряжение (см. дальше)
2) капиллярные явления (поверхностные явления на границе жидкости с другой средой, связанные с искривлением ее поверхности)
Функция Лапласа (формула для капиллярного давления) 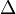 P = σ(dS/dV)
P = σ(dS/dV)
3 ) адгезия (характеризует прилипание вещества одной фазы к другой фазе) и когезия (сцепление частей одного и того же однородного тела (жидкого или твердого))
4) трения
5) адсорбционные и десорбционные явления
Уравнение адсорбции Гиббса: Γ = -(∂σ/∂μ)T
6) смачивание (поверхностное явление, наблюдаемое при контакте жидкости с твердым телом в присутствии третьей фазы-газа (пара) или другой жидкости, которая не смешивается с первой. Характерная особенность смачивания - наличие линий контакта трех фаз (линии смачивания).
Основные термодинамические характеристики смачивания - равновесный краевой угол смачивания q0, работа адгезии Wa, теплота смачивания qW. Равновесный краевой угол смачивания определяется наклоном поверхности жидкости (напр., капли) к смоченной ею поверхности твердого тела; вершина угла находится на линии смачивания. Равновесный краевой угол определяется уравнением Юнга:
cosq0 = (ss-ssl)/ssl,
где ss и ssl-соотв. удельной поверхностные энергии твердого тела на границе с газом и в контакте со смачивающей жидкостью, sl-поверхностное натяжение жидкости.
Термодинамика поверхности:
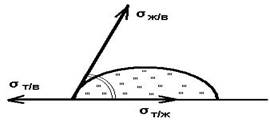
поверхностные явления принято классифицировать в соответствии с объединенным уравнением первого и второго начал термодинамики.
Это уравнение записывается в виде:
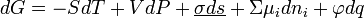
где σdS – поверхностная энергия [Дж/м^2=Н/м]
Поверхностная энергия – энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объёме. Кристаллические вещества характеризуются анизотропией поверхностной энергии: наименьшей поверхностной энергией обладают грани с наибольшей плотностью частиц.
Поверхностное натяжение: σ = (dG/dS)T,p,ni
Т.е поверхностное натяжение — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Стремление поверхностной энергии к минимуму вызывает искривление поверхности жидкости. Поэтому можно предположить наличие связи между поверхностной энергией и формой.
Электронные свойства поверхности отличаются от объёмных, в частности наличием электронных поверхностных состояний. Соответствующие им волновые функции электронов экспоненциально затухают при удалении от поверхности.
Особыми свойствами обладают и родственные поверхностным слоям малые (хотя бы в одном измерении) объекты - тонкие плёнки и нити, узкие щели и поры, капли, кристаллы и полости микроскопических размеров. Изучение тонких плёнок и мономолекулярных слоев даёт сведения о природе межмолекулярного взаимодействия и строения молекул.
При наличии на поверхности двумерных фазовых переходов, а также при пересечении поверхностей образуются межфазные линии - одномерные аналоги межфазных поверхностей, с существованием которых связаны линейные явления. Неоднородная линейная область является одномерным аналогом поверхностного слоя и обладает линейным натяжением, линейной свободной энергией и т. д. Удельные линейные термодинамические потенциалы отличаются от поверхностных лишь тем, что относятся к единице длины (измеряются в Дж/м). Линейные явления существенны лишь для очень малых объектов (зародышей двумерных фаз, смачивающих микрокапель и т. п.).
Адсорбционные и десорбционные явления
При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами – соответственно физическую и химическую адсорбцию.
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на угле.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах.
Явления физической и химической адсорбции чётко различаются в очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум.
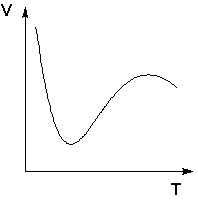
Зависимость объема адсорбированного никелем водорода от температуры
Виды адсорбции:
Теория мономолекулярной адсорбции Ленгмюра
Теория мономолекулярной адсорбции, которую разработал американский химик И.Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
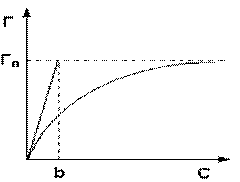
Изотерма мономолекулярной адсорбции
В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров (х), а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата на долю свободных активных центров (1 – х):
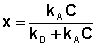
Разделив числитель и знаменатель правой части уравнения на kA, получим:
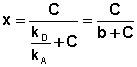
Максимально возможная величина адсорбции Го достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. х = 1. Отсюда следует, что х = Г / Го.
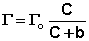
Уравнение есть изотерма мономолекулярной адсорбции, связывающая величину адсорбции Г с концентрацией адсорбата С. Здесь b – некоторая постоянная для данной пары адсорбент-адсорбат величина (отношение констант скоростей десорбции и адсорбции), численно равная концентрации адсорбата, при которой занята половина активных центров. График изотермы адсорбции Ленгмюра приведен на рис. Константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0.
При описании процесса адсорбции газов в уравнении концентрация может быть заменена пропорциональной величиной парциального давления газа:
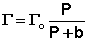
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
Теория полимолекулярной адсорбции Поляни
На практике часто (особенно при адсорбции паров) встречаются т.н. S-образные изотермы адсорбции, форма которых свидетельствует о возможном, начиная с некоторой величины давления, взаимодействии адсорбированных молекул с адсорбатом.
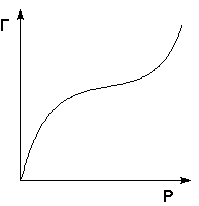
Изотерма полимолекулярной адсорбции
Для описания таких изотерм адсорбции М. Поляни предложил теорию полимолекулярной адсорбции, основанную на следующих основных положениях:
1. Адсорбция вызвана чисто физическими силами.
2. Поверхность адсорбента однородна, т.е. на ней нет активных центров; адсорбционные силы образуют непрерывное силовое поле вблизи поверхности адсорбента.
3. Адсорбционные силы действуют на расстоянии, большем размера молекулы адсорбата. Иначе говоря, у поверхности адсорбента существует некоторый адсорбционный объём, который при адсорбции заполняется молекулами адсорбата.
Особенности атомной структуры поверхностного слоя:
Специфика атомной структуры вблизи поверхности твёрдых тел проявляется, в так называемых, поверхностных релаксации и реконструкции. При релаксации структура атомных плоскостей, параллельных поверхностей, сохраняется такой же, как в объёме, но межплоскостные расстояния у поверхности изменяются. При реконструкции симметрия решётки в приповерхностной области резко отличается от таковой в объёме. Это явление характерно в первую очередь для кристаллов с ковалентной связью(напр., Si и Ge). Вследствие сильно анизотропного характера ковалентного взаимодействия нарушение периодичности решётки при образовании поверхности влечёт за собой коренную перестройку геометрии межатомных связей у поверхности. Обнаружена также реконструкция поверхности ряда переходных и благородных металлов.
Поверхностная релаксация — модификация приповерхностного слоя кристалла, при которой атомная структура верхнего слоя остается той же, что и у соответствующих атомных плоскостей в объеме, но расстояние между первым и вторым слоем или их взаимное положение отличаются от таковых в объеме.
Релаксация подразделяется на нормальную и латеральную, называемую также параллельной или тангенциальной. Нормальная релаксация соответствует случаю, когда атомная структура верхнего слоя та же, что и в объеме, но расстояние между верхним и вторым слоем отличается от расстояния между плоскостями в объеме (рис. а). В чистом виде нормальная релаксация наблюдается в металлах. В большинстве случаев имеет место уменьшение первого межслоевого расстояния; для более глубоких слоев отклонение от объемного значения межслоевого расстояния уменьшается с глубиной. Иногда также наблюдается однородное смещение верхнего слоя параллельно поверхности (рис. б); в этом случае говорят о параллельной или тангенциальной релаксации. Она наблюдается в основном на высокоиндексных плоскостях с низкой концентрацией атомов.
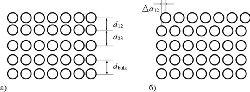 | Схематическая иллюстрация нормальной (а) и латеральной (б) релаксаций верхнего атомного слоя полубесконечного кристалла |
 2015-06-14
2015-06-14 12284
12284