Пример 17. Вычислить концентрацию ионов [Ba2+]: а) в насыщенном водном растворе; б) в растворе, содержащем кроме того 0,1 моль/л Na2SO4;
Решение:
а) BaSO4 ⇄ [Ba2+]·[SO42–]; ПР = [Ba2+]·[SO42–]
Обозначим: [Ba2+] = [SO42–] = x, тогда ПР = [Ba2+]·[SO42–] = x2;
ПР = x2 = 1,08·10–10; x = [Ba2+] = 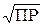 = 1,04·10–5моль/л;
= 1,04·10–5моль/л;
б) если [SO42–] = 10–1моль/л, то [Ba2+] = 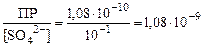 моль/л., то есть добавление одноименного иона приводит к уменьшению растворимости осадка и соответствующему уменьшению концентрации ионов.
моль/л., то есть добавление одноименного иона приводит к уменьшению растворимости осадка и соответствующему уменьшению концентрации ионов.
Солевой эффект - повышение растворимости осадка в присутствии постороннего электролита.
Для сильных электролитов степень диссоциации - кажущаяся, и концентрация ионов заменяется их активностью: α - «кажущаяся»; С (иона) = С·α·n;
a (иона) = C(иона) ·ƒ; тогда в выражении ПР появляются коэффициенты активности ионов. Например, для BaSO4:
ПР = [Ba2+]·ƒ Ba2+ [SO42–]·ƒ SO42–;
[Ba2+][SO42–] = 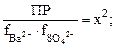 x =
x = 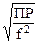 .
.
lgƒ = 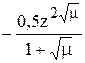 ;
; 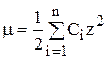 ;
;
при μ ≤ 0,005 lg f = – 0,5z2 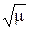 ;
;
Пример 18. Во сколько раз растворимость BaSO4 в 0,1 М растворе КNО3 больше, чем в чистой воде?
Решение:
Сильный электролит КNО3 создает ионную силу в растворе:
μ = ½{[K+]·12 + [NO3–]·12} = ½(0,1 + 0,1) = 0,1;
Коэффициент активности можно найти из таблицы 1.
Таблица 1.
Значения коэффициентов активности
| Ионная сила, μ | однозарядные ионы | двухзарядные ионы | трехзарядные ионы | четырехзарядные ионы |
| 0,001 | 0,96 | 0,86 | 0,73 | 0,56 |
| 0,005 | 0,92 | 0,72 | 0,51 | 0,30 |
| 0,01 | 0,89 | 0,63 | 0,39 | 0,19 |
| 0,05 | 0,81 | 0,44 | 0,15 | 0,04 |
| 0,1 | 0,78 | 0,33 | 0,08 | 0,01 |
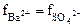 = 0,33; [Ba2+] = [SO42–] = x;
= 0,33; [Ba2+] = [SO42–] = x; 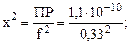
x = 3,2·10–5 моль/л;
Концентрация [Ba2+] в отсутствие постороннего электролита (в воде) составляет [Ba2+] = 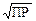 = 1,04·10–5моль/л. Сравнение полученных величин 3,2·10–5/1,04·10–5 ≈ 3, показывает, что растворимость повысилась в 3 раза.
= 1,04·10–5моль/л. Сравнение полученных величин 3,2·10–5/1,04·10–5 ≈ 3, показывает, что растворимость повысилась в 3 раза.
Добавление сильных электролитов к растворам трудно-растворимых веществ приводит к повышению растворимости - солевому эффекту.
Пример 19. Во ск. раз растворимость BaSO4 в 0,1 М растворе КNО3 больше, чем в чистой воде?
Решение: μ = ½{[K+]·12 + [NO3–]·12} = ½(0,1 + 0,1) = 0,1;
Из таблиц: 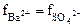 = 0,33; [Ba2+] = [SO42–] = x;
= 0,33; [Ba2+] = [SO42–] = x;
x2 = 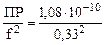 ; x = 3,2·10–5;
; x = 3,2·10–5;
В воде: [Ba2+] = 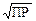 = 1,04·10–5моль/л; в присутствии 0,1 KNO3 3,2·10-5. Сравниваем эти величины 3,2·10–5/1,04·10–5 ≈ 3, и получаем, что растворимость повысилась в 3 раза.
= 1,04·10–5моль/л; в присутствии 0,1 KNO3 3,2·10-5. Сравниваем эти величины 3,2·10–5/1,04·10–5 ≈ 3, и получаем, что растворимость повысилась в 3 раза.
 2015-06-14
2015-06-14 4209
4209
