Абсолютно нерастворимых осадков не существует, любой осадок хоть незначительно, но растворяется, а растворенная часть полностью диссоциирована на ионы:
AgClтв⇄ AgCl(раствор) = Ag+ + Cl–;
Между осадком и ионами в растворе устанавливается равновесие:
AgClтв⇄ Ag+ + Cl–, которое количественно описывается величиной константы равновесия, называемой произведением растворимости:
ПР = [Ag+]·[Cl–]
Произведение растворимости – произведение концентраций ионов в насыщенном растворе трудно-растворимых веществ при данной температуре. Это величина постоянная и зависит только от температуры.
Например, для Ag2S↓⇄2Ag+ + S2–, ПР = [Ag+]2·[ S2–];
для Ag3PO4↓⇄ 3Ag+ + PO43–, ПР = [Ag+]3·[ PO43–].
Пример 13. Произведение растворимости сульфата серебра равно 7,0·10–5. Образуется ли осадок, если к 0,02 н раствора AgNO3 прибавить равный объем 1н раствора H2SO4?
Решение: 2AgNO3 + H2SO4 = Ag2SO4 + 2HNO3, ПР = [Ag+]2·[ SO42–].
Осадок выпадет, если [Ag+]2·[ SO42–] > ПР, т.е. > 7,0·10–5.
Исходные молярные концентрации растворов: 1 н (H2SO4) = 0,5 М; [Ag NO3] = 0,02 моль/л;
При сливании равных объемов растворов концентрация каждого уменьшится в 2 раза: [H2SO4] = 0,25; [Ag NO3] = 0,01 М. При полной диссоциации электролитов концентрации ионов равны: [SO42–] = 0,25 М; [Ag+] = 0,01; а их произведение [Ag+]2·[ SO42–] = 0,012 · 0,25 = 2,5·10–3.
2,5·10–3> ПР т.е. > 7,0·10–5, значит осадок выпадет.
Пример 14. Вычислить растворимость (Р) осадкаFeS и концентрацию ионов [Fe2+] и [S2–] в моль/л и г/л, если ПРFeS = 3,7·10–19.
Решение:
FeS D Fe2+ + S2– ПР = [Fe2+]·[S2–]
Из одного моля растворенной части осадка FeS образуется по одному иону [Fe2+] и [S2–]. Обозначим их как x и подставим в выражение ПР:
x 2 = ПР; x = 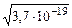 = 6·10–10;
= 6·10–10;
Р(FeS) = 6·10–10 моль/л или 6·10–10 · 88 = 5,3·10–8 г/л;
[Fe2+] = 6·10–10 моль/л или 6·10–10 · 56 = 3,4 ·10–8 г/л;
[S2–] = 6·10–10 моль/л или 6·10–10 · 32 = 1,9 ·10–8 г/л.
Пример 15. Вычислить растворимость (Р) осадкаSb2S3 и концентрацию каждого из ионов, если ПР(Sb2S3) = 3·10–27.
Решение: Обозначим Р (растворимость) Sb2S3 как x моль/л. Так как диссоциация Sb2S3 идет по уравнению Sb2S3 D 2Sb3+ + 3S2–, то, следовательно, при полном распаде x молей Sb2S3 в растворе окажутсямоль ионов 2 x сурьмы и 3 x серы.
ПР(Sb2S3) = [Sb3+]2 · [S2–]3; ПР(Sb2S3) = [2 x ]2 · [3 x ]3 = 108 x 5 = 3·10–27;
Р (Sb2S3) = 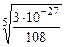 = 2·10–6 моль/л или 2·10–6 ·340 ≈ 0,7·10–3г/л;
= 2·10–6 моль/л или 2·10–6 ·340 ≈ 0,7·10–3г/л;
[Sb3+] = 4·10–6 моль/л или 122· 4·10–6 = 4,9·10–4 г/л;
[S2–] = 6·10–6 моль/л или 32· 6·10–6 ≈ 1,9·10–4 г/л.
Пример 16. Вычислить произведение растворимости гидроксида магния при 180С, если его растворимость при этой температуре равна 1,7·10–4 моль/л;
Решение:
При растворении каждого моля Мg(ОН)2 в раствор переходит
1 моль ионов Мg2+ и вдвое больше ионов ОН–. Следовательно в насыщенном растворе Мg(ОН)2
[Mg2+]= 1,7·10-4 моль/л; [ОН– ]= 3,4·10-4 моль/л. Отсюда:
ПР Мg(ОН)2 =[Mg2+]·[ОН– ]2 = 1,96·10–11.
 2015-06-14
2015-06-14 4745
4745
