(максимальный рейтинг 5 баллов)
Варианты контрольных работ (всего 8 задач каждому)
| № варианта | Номера заданий относящихся к данной работе | |||||||
Вариант совпадает с Вашим номером в списке группы!
Способы выражения состава растворов
501. Из растворов сульфатов металлов в гидрометаллургии получают металлы электролизом и вытеснением более активными металлами (цементацией). Определите массу вещества, необходимую для приготовления 500 дм3 раствора сульфата цинка с концентрацией 0,2 М. Плотность принять равной 1 г/см3.
502. Вычислите процентное содержание серной кислоты в 5 М растворе (ρ = 1,29 г/см3).
503. В 256 г воды растворили 80 мл этанола (ρ = 0,8 г/см3). Рассчитайте процентную и молярную концентрации полученного раствора, если плотность раствора равна 0,97 г/см3.
504. Рассчитайте объемы воды и 10 %-ного раствора хлорида бария (ρ = 1,012 г/см3), которые необходимо взять для приготовления 1 л 2 %-ного раствора хлорида бария (ρ = 1,012 г/см3).
505. Рассчитайте молярную и нормальную концентрации соляной кислоты в растворе с массовой долей соляной кислоты 38 % (ρ = 1,19 г/см3).
506. При охлаждении 300 г 15 %-ного раствора хлорида натрия часть соли выпала в осадок, а массовая доля соли уменьшилась до 8 %. Какова масса осадка?
507. До какого объема надо разбавить 100 мл 5 М раствора H2SO4, чтобы получить 0,25 М раствор серной кислоты? Определите эквивалентную концентрацию полученного раствора серной кислоты.
508. Водный раствор аммиака массой 3,12 г разбавлен в мерной колбе вместимостью 250 мл. На титрование 10 мл разбавленного раствора затрачено 8,4 мл титранта с молярной концентрацией эквивалентов С 2 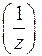 (HCl) = 0,107 моль/л. Рассчитайте массовую долю аммиака в исходном растворе.
(HCl) = 0,107 моль/л. Рассчитайте массовую долю аммиака в исходном растворе.
509. Рассчитайте объемы 2,5 %-ного раствора KMnO4 и воды, которые нужно взять для приготовления 40 мл 0,05 %-ного раствора. Плотность 0,05 %-ного раствора равна 1,003 г/мл, а 2,5 %-ного – 1,017 г/мл.
510. К 0,5 л раствора серной кислоты (ω = 98 %, ρ = 1837 кг/м3) прибавлено 3 л воды. Определите массовую долю H2SO4 в полученном растворе.
511. Смешали 0,8 л 1,5 н раствора NaOH и 0,4 л 0,6 н раствора NaOH. Определите молярную концентрацию эквивалентов полученного раствора.
512. Какой объем раствора соляной кислоты с массовой долей ω (HCl) = 30 % (ρ = 1149 кг/м3) следует добавить к 5 л 0,5 н раствора HCl для получения 1 н раствора данной кислоты?
513. К 0,8 л раствора гидроксида натрия (ω = 30 %, ρ = = 1328 кг/м3) прибавлено 0,4 л раствора едкого натра, массовая доля NaOH в котором равна 14 % мас. (ρ = 1153 кг/м3). Определите плотность полученного раствора и массовую долю NaOH в нем.
514. В каком количестве (г) воды следует растворить 100 г кристаллогидрата MgSO4 · 7H2O для получения раствора, содержащего 5 % безводной соли?
515. Вычислите процентное содержание безводной соли в растворе, полученном растворением 0,01 моль кристаллогидрата Al2(SO4)3 · 18H2O в 1 моль воды.
516. Сколько миллилитров 5,5 %-ного раствора HNO3 (ρ = = 1,03 г/см3) потребуется для нейтрализации 60 мл 12 %-ного раствора KOH (ρ = 1,1 г/см3)?
517. Сколько литров 0,1 н раствора AgNO3 необходимо для реакции с 0,5 л 0,3 н раствора AlCl3?
518. Каким объемом 8 н раствора H2SO4 можно полностью перевести в сульфат 2,65 л 18 %-ного раствора карбоната натрия (ρ = 1,52 г/см3)?
519. Сколько миллилитров 0,1 н раствора фосфорной кислоты можно приготовить из 80 мл 0,75 н раствора той же кислоты?
520. Сколько литров 0,1 н раствора H2SO4 можно приготовить из 70 мл 50 %-ного раствора серной кислоты (ρ = 1,40 г/см3)?
521. К 100 мл 96 %-ного раствора серной кислоты (ρ = = 1,84 г/см3) прибавили 400 мл воды. Получился раствор плотностью 1,220 г/см3. Вычислите эквивалентную концентрацию и массовую долю полученного раствора H2SO4.
522. Какой объем 6 М раствора HCl необходимо взять для приготовления 25 мл 2,5 М раствора HCl?
523. В 180 г воды растворили 9,8 г серной кислоты. Определите мольную долю и моляльную концентрацию полученного раствора.
524. Определите массу (г) перманганата калия, необходимую для приготовления 0,5 л 0,2 н раствора, предназначенного для изучения окислительных свойств этого вещества в кислотной среде.
525. Какой объём воды следует прибавить к 100 мл 20 %-ного раствора серной кислоты с плотностью 1,14 г/мл, чтобы получить 5 %-ный раствор?
526. В 800 г воды растворили диоксид серы объёмом 7,84 л (н.у.). Вычислите массовую долю оксида в полученном растворе.
527. Сколько миллилитров 25 %-ного раствора хлорида натрия (ρ = 1,19 г/мл) необходимо взять для приготовления 250 мл 3 М раствора NaCl?
528. На нейтрализацию 31 см3 раствора щелочи с эквивалентной концентрацией 0,16 моль/л требуется 217 см3 раствора серной кислоты. Вычислите эквивалентную концентрацию и титр раствора серной кислоты.
529. Какой объём раствора серной кислоты с массовой долей 30 % мас. (ρ = 1219 кг/м3) можно приготовить из 12 кг раствора серной кислоты с массовой долей серной кислоты 60 %?
530. Рассчитайте эквивалентную концентрацию бихромата калия, если в 250 мл раствора содержится 0,74 г этого вещества.
531. Определите реакцию среды (кислая, нейтральная или щелочная) после сливания 20 мл 0,5 н раствора кислоты и 40 мл 0,2 н раствора щелочи. Ответ объясните.
532. Определите молярную эквивалентную массу щелочи, если на нейтрализацию 8 г данной щелочи израсходовано 2 л 0,1 н раствора кислоты.
533. Выразите в мольных процентах состав сплава, содержащего 36 % мас. серебра и 64 % мас. меди.
534. Выразите в массовых и мольных процентах элементный состав халькопирита (CuFeS2).
535. Сколько граммов серебра нужно добавить к 34,15 г золота, чтобы получить сплав, содержащий 25 % мол. серебра?
536. Какова мольная доля каждого компонента в расплаве, содержащем 66 % мас. KF и 34 % мас. СаCl2?
537. Сколько граммов FeSO4 × 7H2O можно получить из 1 дм3 12 % мас. раствора безводной соли FeSO4, плотность которого равна 1,122 г/мл?
538. Чему равен титр 0,205 М и молярная эквивалентная концентрация раствора медного купороса?
539. Растворы серной кислоты используют для «травления» – снятия окисной пленки с поверхности металлов. Какой объем 70 %-ного раствора серной кислоты (r = 1,62 г/см3) требуется для приготовления 3 л 2 н раствора?
540. Рассчитайте содержание (% мас.) NaF в расплаве криолита 3NaF × AlF6, который применяется при электрохимическом получении алюминия.
541. В шлаках концентрируются примеси сопутствующих элементов в процессе металлургических плавок. Состав и температуру плавления шлаков регулируют, изменяя соотношение компонентов. В каких соотношениях необходимо взять исходные шлаки состава I и состава II, чтобы получить шлак состава III? Ответ подтвердите расчетами.
| Состав I, % мас. | Состав II, % мас. | Состав III, % мас. |
| СaO – 30; SiO2 – 40; Al2O3 – 30 | СaO – 60; SiO2 – 20; Al2O3 – 20 | СaO – 40; SiO2 – 33; Al2O3 – 27 |
542. Кислоты, содержащиеся в сточных водах гидрометаллургических производств, нейтрализуют известковым молоком (раствором Са(ОН)2). Сколько литров известкового молока, содержащего 100 г/л СаО, требуется для нейтрализации 50 л 6 %-ного раствора соляной кислоты (r = 1,029 г/см3)?
543. Достаточно ли 100 л известкового молока, содержащего 230 г/дм3 СаО (r = 1,18 г/см3), для нейтрализации 0,25 м3 5,5 %-ного раствора азотной кислоты (r = 1,030 г/см3)? Ответ подтвердите расчетами.
544. Содержание серебра в растворе можно определить, осаждая его в составе хлорида серебра. Для осаждения серебра из 160 мл раствора нитрата серебра израсходовали некоторый объем раствора, содержащего 9,24 г NaCl. Чему равна нормальная концентрация раствора нитрата серебра?
545. Для обезвреживания газов, содержащих хлор и хлористый водород, применяют раствор едкого натра. Сколько литров 20 %-ного раствора NaOH (r = 1,219 г/см3) требуется для нейтрализации 20 м3 HCl?
546. Оксиды некоторых металлов (титана, магния, циркония) превращают в хлориды, воздействуя на них хлором в расплаве солей. Растворимость хлора в расплавленном хлориде магния при 850 °С и давлении 1 атм составляет 5 × 10–4 моль/л. Выразите растворимость хлора в см3/л расплава.
547. Сульфат никеля входит в состав электролита для никелирования. При 80 °С в 1000 г воды растворяется 667 г безводного сульфата никеля (II). Сколько NiSO4 × 6H2O выделится из раствора при охлаждении его до 0 °С, если растворимость NiSO4 при этой температуре равна 281 г в 1000 г воды?
548. Кислород, содержащийся в воде, усиливает коррозию многих материалов. Растворимость кислорода в воде при 0 °С равна 0,049 объема на 1 объем воды. Сколько граммов кислорода содержится в 50 л воды, насыщенной под давлением 10 атм?
549. Четыреххлористый титан TiCl4, получаемый как промежуточный продукт при производстве металлического титана, содержит при 20 °С 0,01 % Cl2 и 0,15 % COCl2 по отношению к массе раствора. Какой объем, измеренный при н.у., занимают хлор и фосген, растворенные в 1 м3 жидкого четыреххлористого титана (r = 1,76 г/см3)?
550. Известны способы использования водорода как восстановителя металлов, содержащихся в растворе. Растворимость водорода в воде при 10 °С равна 0,02 объема Н2 на 1 объем воды. Какой объем водорода, измеренный при н.у., выделится из 100 л воды, насыщенной водородом под давлением 10 атм, при падении давления до 1 атм?
 2015-06-14
2015-06-14 2015
2015







