Водородный показатель, pH вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в моль на литр:
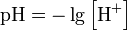
Вывод значения pH:
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль/л (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает.
Когда [H+] > [OH−] говорят, что раствор является кислым, а при [OH−] > [H+] — щелочным.
Методы определения значения pH
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
 2015-06-14
2015-06-14 604
604







