n(смеси газов) = 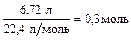
М(смеси газов) = 6,7 × 4 г/моль = 26,8 г/моль
m(смеси газов) = 26,8 г/моль × 0,3 моль = 8,04 г
Пусть n(СН4) = х моль n(H2S) = (0,3 - х) моль
16х + 34(0,3 - х) = 8,04 х = 0,12
n(СН4) = 0,12 моль n(H2S) = 0,18 моль
0,04 моль 0,48 моль 0,16 моль 0,12 моль
Al4C3 + 12HCl = 4AlCl3 + 3CH4
1 моль 12 моль 4 моль 3 моль
144 г/моль 36,5 г/моль 133,5 г/моль 16 г/моль
0,06 моль 0,36 моль 0,12 моль 0,18 моль
Al2S3 + 6HCl = 2AlCl3 + 3H2S
1 моль 6 моль 2 моль 3 моль
150 г/моль 34 г/моль
n(HCl) = 0,48 + 0,36 = 0,84 моль
m(р-ра HCl) = (0,84мл × 36,5г/мл):0,14 = 219мл
m(Al4C3) = 0,04 моль × 144 г/моль = 5,76 г
m(Al2S3) = 0,06 моль × 150 г/моль = 9 г
m(смеси) = 5,76 + 9 = 14,76 г
m(р-ра после реакции) = 219 + 14,76 - 8,04 = 225,72 г
n(AlCl3) = 0,16 + 0,12 = 0,28 моль
w%(AlCl3) = ((0,28моль × 133,5г/моль): 225,7г) × 100% = 16,56%
w%(Al4C3) = (5,7г: 14,76г) × 100%=39,02%
w%(Al2S3) = (9г: 14,76г) × 100% = 60,98%
0,04 моль 0,16 моль
Al4C3 + 4NaOH + 12H2O = 2Na[Al(OH)4] + 3CH4
1 моль 4 моль
0,06 моль 0,48 моль
Al2S3 + 8NaOH = 2Na[Al(OH)4] + 3Na2S
1 моль 8 моль
n(NaOH) = 0,16 + 0,48 = 0,64 моль
V(p-pa NaOH) = (0,64моль× 40г/моль)×: (0,25 × 1,28г/мл) = 80 мл
Решите:
· Смесь алюминия и сульфида алюминия реагирует с 20%-ным раствором серной кислоты с выделением 10,08 л смеси газов (н. у.), относительная плотность которой по водороду равна 4,2. Определите массовые доли алюминия и сульфида алюминия в смеси, массовую долю сульфата алюминия в полученном растворе.
· При взаимодействии смеси карбида и карбоната кальция с 24%-ным раствором соляной кислоты выделяется смесь газов объемом 3,92 л (н. у.), относительная плотность которой по водороду равна 16,343. Определите массовые доли компонентов в смеси, объемные доли газов в смеси, массовую долю хлорида кальция в растворе после реакции.
4. Какой объем 16%-го раствора сульфида натрия (r = 1,189 г/мл) вступит в реакцию с 111,6 мл 20%-го раствора сульфата алюминия (r = 1,226 г/мл)?
Решение:
Al2(SO4)3 + 3Na2S + 6H2O = 2Al(OH)3¯ + 3H2S + 3Na2SO4
1 моль 3 моль
342 г/моль 78 г/моль
n(Al2(SO4)3) = 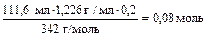
n(Na2S) = 3n(Al2(SO4)3) = 3 × 0,08 моль = 0,24 моль
V(p-pa Na2S) = 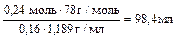
Решите: Какой объем 16%-го раствора карбоната натрия (r = 1,17 г/мл) вступит в реакцию с 10 мл 20%-го раствора хлорида железа (III) (r = 1,182 г/мл).
5. Железо массой 16,8 г полностью реагирует с 145,19 мл 18%-го раствора серной кислоты в инертной атмосфере. Определите плотность раствора серной кислоты и массовую долю сульфата железа в растворе после реакции.
Решение:
0,3 моль 0,3 моль 0,3 моль 0,3 моль
Fe + H2SO4 = FeSO4 + H2
1 моль 1 моль 1 моль 1 моль
56 г/моль 98 г/моль 152 г/моль 2 г/моль
n(Fe) = 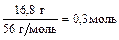
r(р-ра H2SO4) = 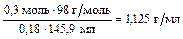
m(p-pa) = 16,8 г + 145,19 мл × 1,125 г/мл - 0,3 моль × 2 г/моль = 179,54 г
w%(FeSO4) = 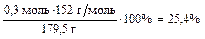
Решите: Алюминий массой 6,48 г полностью реагирует с 119,5 мл 20%-го раствора соляной кислоты. Определите плотность раствора соляной кислоты, массовую долю хлорида алюминия в растворе после реакции.
6. Определите массу осадка, образующегося при взаимодействии 141,5 мл 20 %-ного раствора хлорида кальция (r = 1,177 г/мл) с 141,6 мл 16 %-ного раствора карбоната натрия (r = 1,17 г/мл)?
 2015-06-14
2015-06-14 385
385








