Вода - не только самый распространенный растворитель, она также является слабым электролитом. По упрощенной схеме ее диссоциацию можно выразить следующим уравнением: Н2О D Н+ + ОН-.
Константа диссоциации воды K д, с = 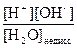 . Поскольку степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул можно принять равной молярной концентрации жидкой воды. Поэтому при Т =const
. Поскольку степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул можно принять равной молярной концентрации жидкой воды. Поэтому при Т =const
[H+]×[OH-] = K д, с [H2O] = const.
Произведение концентраций ионов [H+] и [ОН-] носит название ионного произведения воды и является постоянной величиной при неизменной температуре. При 298К:
[H+]×[ОН-] = K (H2O) = K В = K w = 10–14. (5)
Ионное произведение воды K w увеличивается с ростом температуры, т.к. диссоциация воды –эндотермический процесс.
Для указания концентрации ионов водорода в растворе используют так называемый водородный показатель:
pH = –lg[H+], (6)
а для обозначения концентрации гидроксид-ионов - гидроксидный показатель:
pOH = –lg[ОН-]. (7)
При температуре 298 К рН + рОН = 14, (8 )
 2015-06-14
2015-06-14 291
291








