Произведение [H+]·[OH-] можно считать постоянным:
KВ·[H2O] = [H+]·[OH-] = 1,8·10-16·55,6 = 1·10-14 (моль/л)
Произведение равновесных концентраций ионов водорода и гидроксила в воде и разбавленных водных растворах (при постоянной температуре) есть величина постоянная - ионное произведение воды (KВ).
KВ = [H+]·[OH-] = 1·10-14 при 25 ° С
При увеличении температуры KВ значительно возрастает:
| t, ° С | ||||||
| KВ·1014 | 0,1139 | 0,5702 | 1,0008 | 1,469 | 5,474 | 9,614 |
Следовательно, в чистой воде при 25 ° С
[H+] = [OH-] = 1·10-7 моль/л.
В водных растворах электролитов молярные концентрации ионов H+ и OH- не обязательно равны 10 моль/л (как в чистой воде), но их произведение при 25 ° С всегда равно 1·10-14. Следовательно, если задано значение [H+], то легко определить и [OH-], и наоборот:
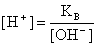
В кислых растворах преобладает концентрация ионов H+:
[H+] > [OH-], т.е. [H+] > 1·10-7 и [OH-] < 1·10-7 моль/л.
В основных растворах преобладает концентрация ионов [OH ]:
[OH-] > [H+], т.е. [OH-] >1·10-7 и [H+] < 1·10-7 моль/л.
 2015-06-14
2015-06-14 424
424








