| Истинный раствор | Коллоидный раствор | Взвесь |
| Молекулярно-дисперсная система | Коллоидно-дисперсная система | Грубодисперсная система |
| Размер частиц | ||
| Менее 1· 10-9 м | 1·10-9 м - 1· 10-7 м | более 1· 10-7 м |
| Частицы нельзя обнаружить оптическими методами | Частицы можно обнаружить с помощью микроскопа | Частицы можно обнаружить визуально или с помощью микроскопа |
| Частицы проходят через бумажный фильтр | Частицы задерживаются бумажным фильтром |
ПРОЦЕСС ОБРАЗОВАНИЯ РАСТВОРОВ. ТЕПЛОВЫЕ ЭФФЕКТЫ ПРИ РАСТВОРЕНИИ
Растворение - сложный физико-химический процесс. В зависимости от природы растворителя и растворенного вещества преобладает либо одна, либо другая его составляющая. Чаще физический процесс предшествует химическому. Д.И. Менделеев, обосновывая теорию растворов, впервые выдвинул идею о существовании в них определенных химических соединений.
При химическом растворении образование раствора происходит в результате реакции между растворенным веществом и растворителем:
SO3 + H2O = H2SO4
Часто растворяемые вещества в ходе реакции переходят в другие соединения, поэтому в итоге образуется раствор продуктов реакции:
2Na + 2H2O = 2NaOH(р) + H2
Cl2 + H2O = HOCl + HCl
Иногда сам растворитель (в данном случае - вода) непосредственно не участвует в реакции:
Mg + 2HCl = MgCl2(р) + H2
Однако, на практике растворы H2SO4, NaOH, MgCl2 и т.д. готовят либо разбавлением более концентрированных растворов указанных веществ (растворы H2SO4), либо непосредственным растворением NaOH(т), MgCl2(т) в растворителе.
Подобные процессы приводят к образованию растворов молекулярного или ионного типа. Если растворение не сопровождается такой выраженной реакцией, как при химическом растворении, то процесс ограничивается взаимодействием молекул растворяемого вещества с молекулами растворителя, который называют сольватацией. Продукты взаимодействия называют сольватами (от лат. solvere - растворять). Если в качестве растворителя используют воду, то процесс называют гидратацией, а продукты взаимодействия - гидратами.
Образование сольватов возможно различными путями в зависимости от природы растворителя и растворяемого вещества. Так, если растворенное вещество имеет ионную структуру, то молекулы растворителя удерживаются у образовавшегося иона за счет электростатических сил взаимодействия. В обычных условиях способность иона гидратироваться зависит от его природы, заряда, размера, строения электронной оболочки и концентрации раствора. Гидратирующая способность ионов падает в ряду:
Al3+ > Cr3+ > Be2+ > Cd2+ > Zn2+ > Mg2+ > Na+.
Гидратация изменяет как свойства растворителя, так и свойства иона. Например, гидратация снижает электрохимическую подвижность (направленное перемещение под действием электрического тока) ионов. Так, электропроводность расплава LiCl выше электропроводности CsCl. В водных же растворах из-за большей гидратирующей способности Li+ по сравнению с Cs+ электропроводность указанных солей имеет противоположный характер.
Под влиянием гидратации деформируются электронные оболочки ионов, что в большинстве случаев приводит к изменению их окраски:
Cu2+ - белый, [Cu(H2O)4]2+ - голубой,
Co2+ - синий, [Co(H2O)6]2+ - розовый,
Ni2+ - желтый, [Ni(H2O)6]2+ - зеленый и т.п.
Гидратированные ионы обладают большей термодинамической устойчивостью, чем ионы, лишенные гидратной оболочки. Часто образующиеся гидраты могут быть настолько прочны, что их можно выделить из раствора в кристаллическом состоянии. Такие кристаллы, содержащие в связанном виде молекулы воды, называют кристаллогидратами (в общем случае - кристаллосольватами), а входящую в их состав воду - кристаллизационной. Например: CuSO4·5H2O, Na2SO4·10H2O, Ni(NO3)2·6H2O и др. Кристаллогидраты сохраняют окраску, характерную для соответствующих растворов. Это служит доказательством существования в растворе аналогичных гидратных комплексов.
При растворении соединений с ионной кристаллической решеткой, например, NaCl в воде процесс гидратации начинается с ориентации диполей воды относительно ионов кристаллической решетки. Когда энергия связи между гидратируемым ионом и молекулами воды становится больше, чем энергия связи между ионами в решетке кристалла, гидратированный ион переходит из кристалла в раствор и происходит постепенное разрушение всего кристалла.
С термодинамической точки зрения вещество может растворяться в растворителе (ж) самопроизвольно при постоянном давлении и объеме, равномерно распределяясь в нем, если в результате этого процесса свободная энергия системы уменьшается:
G = ( H - T· S) < 0
Если вещество переходит из упорядоченного (ж) или (т) состояния в раствор, в котором термодинамическая вероятность состояния его частиц значительно больше, то энтропия системы увеличивается: S>0. Это способствует растворению вещества. Вклад энтропийного фактора будет особенно ощутим при повышенных температурах, поэтому растворимость твердых и жидких веществ при нагревании, как правило, увеличивается (рис.6.1.).
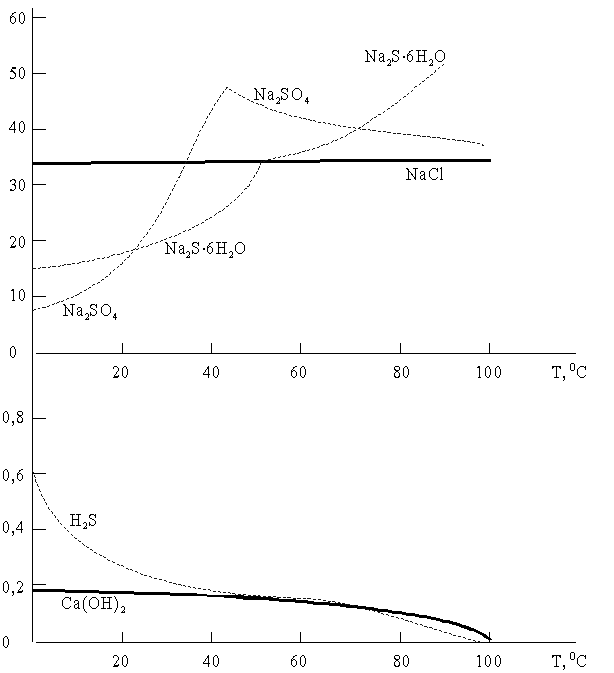
Рис. 6.1. Зависимость растворимости некоторых веществ от температуры.
При переходе вещества из (г) состояния в раствор энтропия системы падает: S < 0. Влияние энтропийного фактора на изменение G является минимальным при низких температурах, поэтому растворимость газов увеличивается при охлаждении.
В процессе растворения энтальпия системы может также увеличиваться или уменьшаться. При растворении вещества происходит разрушение его структуры, разрыв связей между ионами, атомами или молекулами, что требует затраты энергии ( Hструкт. > 0). Причем, чем больше энергия связи между частицами в веществе, тем выше Hструкт. Одновременно происходит взаимодействие частиц растворяемого вещества с растворителем, сопровождающееся выделением энергии ( Hсольв. < 0). Общий энергетический эффект зависит от соотношения выделяемой и поглощаемой энергии:
Hраств. = Hкрист. + Hсольв.
Если энергия, затраченная на разрыв связей в исходном веществе больше, чем выделившаяся при образовании сольватов, то растворение вещества сопровождается поглощением энергии и снижением температуры раствора. В этом случае | Hструкт.| > | Hсольв.| и Hраств. > 0, и процесс растворения является эндотермическим. Так, например, при растворении ионных кристаллов и других веществ, в которых под действием растворителя происходит разрыв химических связей, величина Hструкт. настолько велика, что не всегда компенсируется энергией взаимодействия растворителя с полученными ионами.
Если, наоборот, энергия, затраченная на разрушение структуры, незначительна по сравнению с энергией, выделяющейся при сольватации, т.е. | Hструкт.| < | Hсольв.|, то процесс растворения сопровождается выделением теплоты и повышением температуры раствора, т.е. является экзотермическим: Hраств. < 0. Например, при растворении газов Hструкт. = 0, т.к. структуры газа не существует. Для молекулярных кристаллов и жидкостей ван-дер-ваальсовы силы взаимодействия между молекулами и даже H-связи недостаточно прочны, и обычно |Hструкт.| < | Hсольв.|. Поэтому растворение газов и таких веществ, как, например, сахар, глицерин, спирт и т.п. является экзотермическим процессом.
Если при растворении молекулярных веществ не происходит заметной сольватации их молекул ( Hсольв 0), а сами молекулы неполярны ( Hструкт. 0), то растворение практически не сопровождается тепловым эффектом. Это наблюдается, например, при растворении иода в четыреххлористом углероде (CCl4). В этом случае движущей силой процесса является увеличение энтропии. Тепловой эффект растворения бывает близким к нулю и при больших значениях Hструкт. и Hсольв., если | Hструкт.| | Hсольв.|.
 2015-06-14
2015-06-14 571
571








