Температура кипения чистой жидкости или раствора – температура, при которой давление насыщенного пара становится равным внешнему давлению.
Температура кипения раствора всегда выше, чем температура кипения растворителя. Повышение температуры кипения будет тем большим, чем выше концентрация раствора, и для разбавленных растворов его можно считать пропорциональным концентрации.
Пусть внешнее давление равно 760 мм рт. ст. Температуры, при которых изобара пересечет кривые ОА, ВС, DE и т. д., будут температурами кипения со 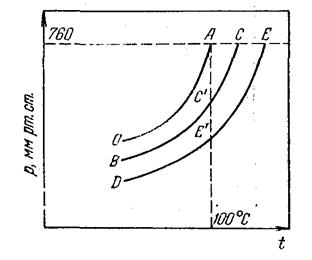 ответствующих жидкостей при этом давлении. Для растворов эти температуры являются более высокими, чем для чистого растворителя, и разность между ними
ответствующих жидкостей при этом давлении. Для растворов эти температуры являются более высокими, чем для чистого растворителя, и разность между ними
ΔΤкип = Τкип – Τкип0
будет тем большей, чем выше концентрация раствора.
Повышение температуры кипения пропорционально понижению давления насыщенного пара и, следовательно, повышение температур кипения пропорционально концентрации раствора
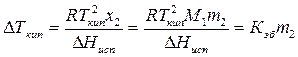
m2 – моляльная концентрация раствора;
х2 – мольная доля растворенного вещества;
∆Нисп – теплота испарения растворителя;
М1 – молярная масса растворителя;
Кзб – эбулиоскопическая постоянная.
Эбулиоскопическую постоянную можно вычислить по формуле:
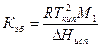
Τкип0 – температура кипения при нормальных условиях;
М1 – молярная масса растворителя;
ΔHисп – теплота испарения растворителя.
Эбулиоскопия – метод изучения свойств растворов, основанный на определении температур их кипения.
 2015-06-14
2015-06-14 1105
1105
