Растворы замерзают при более низкой температуре, а кипят при более высокой температуре, чем чистый растворитель. Понижение температуры замерзания и повышение температуры кипения раствора пропорционально моляльной концентрации растворенного вещества (II закон Рауля), т.е.
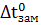 =
= 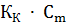 ;
;
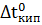 =
= 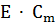 ;
;
где 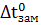 - понижение температуры замерзания раствора;
- понижение температуры замерзания раствора;
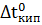 - повышение температуры кипения раствора;
- повышение температуры кипения раствора;
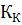 - криоскопическая константа;
- криоскопическая константа;
Е - эбулиоскопичеекая константа;
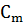 - моляльная концентрация растворенного вещества.
- моляльная концентрация растворенного вещества.
Если “ m “ граммов неэлектролита, имеющего молярную массу М, растворены в m граммах растворителя, то закон Рауля для неэлектролитов можно записать в следующие виде:
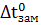 =
= 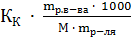 и
и 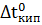 =
= 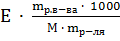 .
.
Указанные формулы позволяют находить молярную массу растворенного вещества.
Пример 1. Определение температуры кипения и замерзания раствора неэлектролита.
Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола 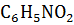 в 10 г бензола. Эбуллиоскопическая и криоскопическая константы бензола соответственно равны 2.57 и 5.1 °С. Температура кипения чистого бензола 80,2 0С, замерзания – 5,4 °С.
в 10 г бензола. Эбуллиоскопическая и криоскопическая константы бензола соответственно равны 2.57 и 5.1 °С. Температура кипения чистого бензола 80,2 0С, замерзания – 5,4 °С.
|
|
|
Решение. По закону Рауля следует, что
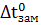 =
= 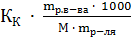 =
= 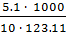 = 4.14
= 4.14 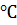
Тогда 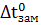 раствора равна
раствора равна 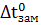 = 5.4 – 4.14 = 1.26
= 5.4 – 4.14 = 1.26 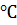 .
.
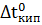 =
= 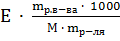 =
= 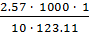 = 2.09
= 2.09 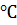 .
.
Температура кипения раствора: 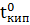 = 80.2 + 2.09 = 82.29 °С.
= 80.2 + 2.09 = 82.29 °С.
Пример 2. Вычисление молярной массы неэлектролита по повышению температуры кипения раствора.
Раствор камфоры массой 0.552 г в 17 г эфира кипит при температуре на 0.461 °С выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2.16 °С. Определите молярную массу камфоры.
Решение. Молярную массу камфоры определяем, пользуясь соотношением
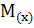 =
= 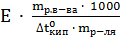 =
= 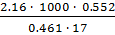 = 155.14.
= 155.14.
Молярная масса камфоры равна 155.14.
Пример 3. Вычисление криоскопической константы растворителя. Вычислите криоскопическую константу воды, если водный раствор этилового спирта
(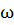 = 0.113) замерзает при - 5 °С.
= 0.113) замерзает при - 5 °С.
Решение. Молярная масса этилового спирта равна 46.07. Из соотношения, приведенного в примере I, получаем
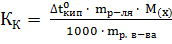 =
= 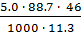 = 1.81
= 1.81 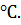
Криоскопическая константа воды 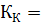 1.81 °С.
1.81 °С.
 2015-01-13
2015-01-13 2541
2541
