Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
Цинк
Цинк (Zinkum) Zn — элемент II группы 4-го периода периодической системы Д. И. Менделеева, п. н. 30, атомная масса 65,37. Известен с древности. Главный минерал — сфалерит (цинковая обманка) ZnS. Цинк — синевато-белый металл, на воздухе покрывается плотной защитной пленкой, которая защищает металл от дальнейшего окисления. В соединениях проявляет валентность 2+. В кислотах и щелочах растворяется с выделением водорода. При растворении в щелочах протекает реакция: Zn + 2NaOH = Na2ZnO2 + Н2
В настоящее время выделены соли, цинкаты, состава: Na[Zn(OH)3], Na2[Zn(ОН)4] и др. Гидроокись Цинка амфотерна, растворяется в кислотах и щелочах, образует комплексные ионы [Zn(NH3)4]2+. Цинк — сильный восстановитель, легко вытесняет из раствора другие металлы (Cu, Cd, Fe и др.). Металлический Цинк применяют для оцинковывания железа, стальных изделий (предохранение от коррозии), для получения медных сплавов (латунь), в гальванических элементах.
Химические свойства Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
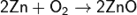
Оксид цинка реагирует как с растворами кислот:
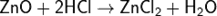
так и щелочами:
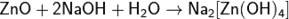
Цинк обычной чистоты активно реагирует с растворами кислот:
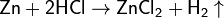

и растворами щелочей:
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4. При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
 2015-06-04
2015-06-04 822
822







