CV – молярная теплоемкость в изохорном процессе (V = const)
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 молягаза следует. Изменение Δ U внутренней энергии газа прямо пропорционально изменению Δ T его температуры. QV = CV Δ T = Δ U.
Cp – молярная теплоемкость в изобарном процессе (p = const).
Qp = Δ U + p (V 2 – V 1) = CV Δ T + p Δ V,
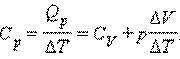
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ. 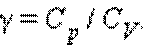
Термодинамические процессы, в которых теплоемкость газа остается неизменной, называются политропическими.
ОСНОВЫ КЛАССИЧЕСКОЙ ТЕОРИИ ТЕПЛОЁМКОСТИ ИДЕАЛЬНОГО ГАЗА
теплоемкость идеальных газов согласно классической теории не зависит от температуры.
 2015-06-16
2015-06-16 574
574








