С жизнедеятельностью клостридиев связаны различные процессы, протекающие в природе: разложение (гниение) азотсодержащих соединений (белков, нуклеиновых кислот) в анаэробных условиях; анаэробное разложение растительных материалов, таких как клетчатка, хитин. Некоторые сахаролитические клостридии могут использовать в качестве субстрата брожения пектиновые вещества, составляющие покровы растительных клеток. Пектин — полимер метил- D -галактуроновой кислоты. Последняя имеет сложное строение и при воздействии на нее пектиновыми ферментами гидролизуется на ряд сахаров, кислот и метиловый спирт. Клостридии, принадлежащие к виду C. felsineum, содержат активную пектиназу и могут поэтому получать энергию, осуществляя маслянокислое брожение пектиновых веществ. Этот вид играет важную роль в процессе мацерации волокон при мочке льна.
Еще в конце прошлого века было обнаружено, что некоторые клостридии патогенны, т. е. вызывают заболевания человека и животных. В основе патогенности клостридиев лежит их способность синтезировать и выделять из клетки высокоэффективные токсины.
Бактерии группы Clostridium находят и практическое применение. Их используют в производстве масляной кислоты, необходимой для парфюмерной промышленности. Ацетоно-бутиловое брожение, осуществляемое некоторыми видами клостридиев, используют для получения в промышленном масштабе ацетона и бутанола. В свое время в нашей стране возникла острая потребность в этих веществах. Получать их химическим путем в то время было гораздо сложнее, чем микробиологически. В 30-х гг. академик В. Н. Шапошников организовал одно из первых в СССР промышленных микробиологических производств, на котором было освоено получение н -бутанола и ацетона с помощью клостридиев.
АЛЬТЕРНАТИВНЫЕ ПУТИ СБРАЖИВАНИЯ УГЛЕВОДОВ
В течение длительного времени считали, что единственным путем сбраживания углеводов является гликолитический путь с различными вариантами метаболизирования пирувата. Однако постепенно накапливались данные, которые определенно указывали на существование иных, чем гликолиз, путей расщепления углеводов. Гликолитическая схема в одних случаях не, могла объяснить использования эубактериями пентоз в качестве энергетического субстрата, а также того, каким путем они синтезируют необходимую для нуклеиновых кислот рибозу, в других — распределения 14C в конечных продуктах брожения.
Работами нескольких лабораторий были расшифрованы еще два пути расщепления углеводов, отличные от гликолитического, получившие название окислительного пентозофосфатного пути (другие названия: гексозомонофосфатный, или фосфоглю-конатный, или путь Варбурга — Диккенса — Хореккера) и 2-кето-3-дезокси-б-фосфоглюконатного (КДФГ), или пути Энтнера — Дудорова 48.
48 Пути названы по имени ученых О. Варбурга (О. Warburg), Ф. Диккенса (F. Dickens), Г. Хореккера (G. Horecker), И. Энтнера (N. Entner) и М. Дудорова (М. Doudoroff), внесших большой вклад в их расшифровку.
ОКИСЛИТЕЛЬНЫЙ ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
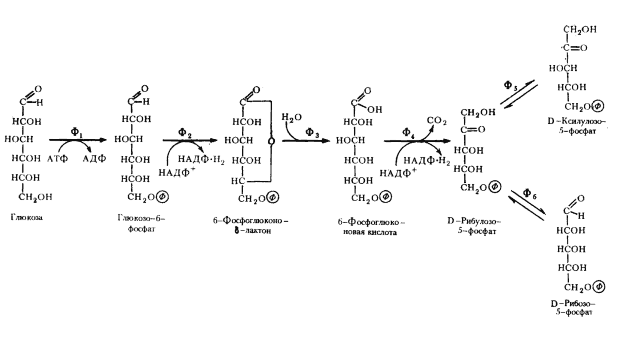
Схема начальных этапов окислительного пентозофосфатного пути представлена на рис. 64. Первая реакция заключается в фосфорилировании глюкозы с помощью АТФ и превращении ее в метаболически активную форму глюкозо-6-фосфата, аналогично тому, что имеет место на первом этапе гликолиза. Следующий этап заключается в дегидрировании глюкозо-6-фосфата, катализируемом глюкозо-6-фосфатдегидрогеназой. Особенность реакции в том, что в ней участвует НАДФ+ в качестве акцептора водорода. Образовавшийся продукт реакции очень нестоек и спонтанно или с помощью фермента лактоназы гидролизуется с образованием 6-фосфоглюконовой кислоты, которая подвергается окислительному декарбоксилированию, катализируемому фосфоглюконатдегидрогеназой. Эта реакция приводит к образованию соответствующего пентозофосфата, НАДФ-H2 и выделению CO2. Рибулозо-5-фосфат обратимо превращается в ксилулозо-5-фосфат и рибозо-5-фосфат с участием ферментов фосфопентозоэпимеразы и фосфопентозоизомеразы соответственно.
Суммарно весь процесс можно представить в виде следующего уравнения:
глюкозо-6-фосфат + 2НАДФ+ рибозо-5-фосфат + CO2 + 2НАДФ-Н2.
Как видно, на этом этапе образуются 2 молекулы НАДФ-H2, которые могут потребляться в восстановительных биосинтетических процессах, и молекула рибозо-5-фосфата, используемого в синтезе нуклеиновых кислот и пентозосодержащих коферментов49. Примечательно, что ни на одном из окислительных этапов не синтезируется АТФ.
49 Некоторые авторы считают, что особенность окислительного пентозофосфатного пути — перенос электронов на окислительных этапах на НАДФ+, а не на НАД+ — в последующем оказалась очень "выгодной" для аэробов, так как позволила иметь два отдельных пула восстановленных пиридиновых переносчиков, с одного из которых (НАД-H2) электроны поступали в дыхательную цепь, а с другого (НАДФ-H2) использовались в биосинтетических восстановительных реакциях.
Первоначально окислительный пентозофосфатный путь возник, вероятно, для обеспечения эубактерий пентозами. В этом случае возникновение только трех новых ферментов (глюкозо-6-фосфатдегидрогеназы, лактоназы и фосфоглюконатдегидрогеназы) уже приводило к синтезу пентоз. Поскольку к этому времени функционировали изомеразные ферменты гликолитического пути (см. рис. 53), формирование фосфопентозоизомеразы произошло довольно легко. Действительно, при определенных условиях окислительный пентозофосфатный путь на этом завершается.
Дальнейшее его развитие, вероятно, связано с энергетическими потребностями клетки. Меньшей части образующегося рибозо-5-фосфата оказалось достаточно для удовлетворения всех потребностей клетки в пентозах. Остальная часть синтезируемого пентозофосфата была субстратом, хранившим в себе большие запасы энергии. Способность использовать в энергетических целях этот субстрат связана с возникновением двух ферментов: фосфопентозоэпимеразы, катализирующей превращение рибулозо-5-фосфата в ксилулозо-5-фосфат (рис. 64), и пентозофосфокетолазы, катализирующей расщепление ксилулозо-5-фосфата на 3-ФГА и ацетилфосфат (рис. 65).
Использование в качестве источника энергии в анаэробных условиях пентозных субстратов, образуемых в окислительном пентозофосфатном пути, свойственно группе гетероферментативных молочнокислых бактерий, для которых характерно образование в качестве конечных продуктов брожения ряда органических соединений: молочной и уксусной кислот, этилового спирта, глицерина, CO2 и др. Этим гетероферментативные молочнокислые бактерии отличаются от гомоферментативных, почти полностью сбраживающих гексозы по гликолитическому пути в молочную кислоту.
|
| Рис. 64. Окислительный пентозофосфатный путь (начальные этапы): Ф1 — гексокиназа; Ф2 — глюкозо-6-фосфатдегидрогеназа; Ф3 — лактоназа; Ф4 — фосфоглюконатдегидрогеназа (декарбоксилирующая); Ф5 — фосфопентозоэпимераза; Ф6 — фосфопентозоизомераза (по Dagley, Nicholson, 1973) |
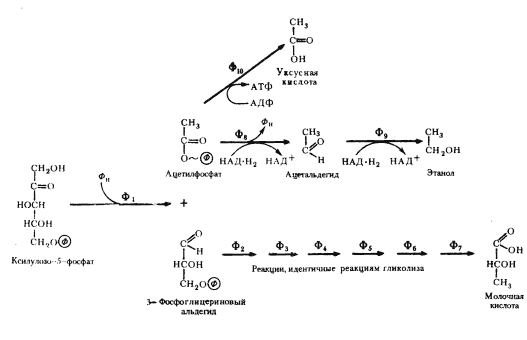
Изучение механизмов образования конечных продуктов брожения гетероферментативными молочнокислыми бактериями обнаружило, что они связаны с дальнейшими различными путями метаболизирования C2- и C3-фрагментов фосфокетолазной реакции. 3-ФГА претерпевает ряд ферментативных превращений, идентичных таковым гликолитического пути, и через пируват превращается в молочную кислоту. Судьба двухуглеродного фрагмента различна: двухступенчатое восстановление ацетилфосфата приводит к накоплению в среде этанола; окислительный путь превращения ацетилфосфата завершается образованием уксусной кислоты (рис. 65).
|
| Рис. 65. Гетероферментативное молочнокислое брожение: Ф1 — пентозофосфокетолаза; Ф2 — 3-ФГА-дегидрогеназа; Ф3 — фосфоглицераткиназа; Ф4 — фосфоглицеромутаза; Ф5 — енолаза; Ф6 — пируваткиназа; Ф7 — лактатдегидрогеназа; Ф8 — ацетальдегиддегидрогеназа; Ф9 — алкогольдегидрогеназа; Ф10 — ацетаткиназа (по Schlegel, 1972) |
Преобладание в ферментационной среде того или иного продукта зависит от вида культуры, условий культивирования и фазы развития. Гетероферментативные молочнокислые бактерии Leuconostoc mesenteroides сбраживают глюкозу в молочную кислоту, этанол и CO2 по следующему уравнению:
C6H12O6 CH3-CHOH-COOH + CH3-CH3-CH2OH + CO2
У других гетероферментативных молочнокислых бактерий больший удельный вес занимают процессы, ведущие к накоплению уксусной кислоты. Образование уксусной кислоты из ацетилфосфата сопряжено с синтезом АТФ. Если брожение идет с образованием этанола, то выход энергии равен 1 молекуле АТФ на молекулу сброженной глюкозы; если образуется уксусная кислота, то общий энергетический баланс процесса составляет 2 молекулы АТФ на молекулу глюкозы, т. е. такой же, как при гликолизе.
Окислительный пентозофосфатный путь функционирует в качестве единственного пути сбраживания углеводов у облигатных гетероферментативных молочнокислых бактерий. Эти бактерии лишены ключевых ферментов гликолитического пути, например альдолазы и триозофосфатизомеразы. Большинство молочнокислых бактерий имеют два пути сбраживания углеводов: гликолитический и окислительный пентозофосфатный. Сбраживание гексоз, как правило, протекает по гликолитическому пути, а пентоз — по окислительному пентозофосфатному. Это имеет место, например у Lactobacillus plantarum. Ферменты окислительного пентозофосфатного пути обнаружены у клостридиев.
Таким образом, возникнув сначала как механизм синтеза клеткой C5-соединений, т. е. для выполнения узкой специфической задачи, этот путь получил дальнейшее развитие и стал выполнять дополнительную функцию снабжения эубактерий энергией в анаэробных условиях. Субстратная база для окислительного пентозофосфатного пути позднее была расширена, так как он стал использоваться и для сбраживания пентоз биогенного происхождения, накапливавшихся в окружающей среде.
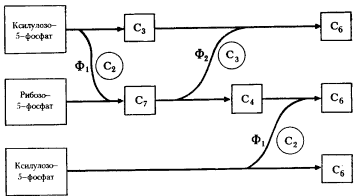
Но на этом пути эволюционное развитие окислительного пентозофосфатного пути расщепления углеводов не остановилось. Была сформирована последовательность реакций, "замыкающая" этот путь в цикл, в результате чего стала возможной полная деградация молекулы сахара. Исходными субстратами на этом пути служат пентозы, образующиеся из рибулозо-5-фосфата, ксилулозо-5-фосфата и рибозо-5-фосфата (см. рис. 64). При участии двух дополнительных ферментов — транскетолазы и трансальдолазы — осуществляется перенос C2- и C3-фрагментов между изомерными пентозо-5-фосфатами и продуктами их взаимопревращений (рис. 66). Сначала транскетолаза переносит C3-фрагмент от молекулы ксилулозо-5-фосфата на молекулу рибозо-5-фосфата, в результате чего образуется C7-сахар и C3-сахар — 3-ФГА. 3-ФГА, образующийся в транскетолазной реакции и, как известно, представляющий собой промежуточный продукт гликолитического пути, является первой точкой, в которой пересекаются эти пути.
Далее трансальдолаза действует на продукты транскетолазной реакции, перенося C3-фрагмент от молекулы C7-сахара на C3-молекулу — 3-ФГА. В результате образуются молекулы C6-и C4-сахара. Один из продуктов реакции — фруктозо-6-фосфат является промежуточным соединением гликолитического пути, поэтому данная реакция есть вторая точка пересечения обоих путей углеводного метаболизма. Наконец, транскетолаза осуществляет перенос C2-фрагмента от молекулы D -ксилулозо-5-фосфата на молекулу C4-сахара по той же схеме, что и в первой транскетолазной реакции.
|
| Рис. 66. Окислительный пентозофосфатный путь (конечные этапы): Ф1 — транскетолаза; Ф2 — трансальдолаза; кружками обведены C2 — гликольальдегидная и C3 — диоксиацетоновая группы; в квадраты заключены C3 — 3-фосфоглицериновый альдегид (3-ФГА), C4 — D -эритрозо-4-фосфат, C6 — D -фруктозо-6-фосфат, C7 — D -седогептулозо-7-фосфат (по Schlegel, 1972) |
Итог этих взаимопревращений таков: из 3 молекул пентозофосфата синтезируются 2 молекулы фруктозо-6-фосфата и 1 молекула 3-ФГА. Фруктозо-6-фосфат ферментативно превращается в глюкозу, и 2 молекулы глюкозы снова возвращаются в цикл. 2 молекулы 3-ФГА также могут конденсироваться с образованием 1 молекулы глюкозы. В результате функционировавания полного окислительного пентозофосфатного пути из 6 поступающих в него молекул глюкозы 5 молекул ревосстанавливаются, а одна полностью окисляется до CO2, что приводит к восстановлению 12 молекул НАДФ+ до НАДФ-H2. Это можно представить в виде следующего уравнения:
6 глюкозо-6-фосфат + 12НАДФ+ 5 глюкозо-6-фосфат + 6CO2 + 12НАДФ-H2 + ФН.
Таким образом, окислительный пентозофосфатный путь может служить циклическим механизмом полной деградации углеводов, при этом водород, отщепленный от глюкозы, поступает в электронтранспортную цепь и переносится на O2.
Остановимся теперь на функциях последнего этапа пути. Как механизм, обеспечивающий полную деградацию углеводов, этот путь не получил универсального распространения, хотя есть эубактерии, осуществляющие разложение углеводов в аэробных условиях только по окислительному пентозофосфатному пути. У многих организмов, использующих пентозы в качестве субстратов брожения, окислительный пентозофосфатный путь служит для превращения пентоз в гексозы, которые затек сбраживаются в гликолитическом пути. Кроме того, выше мы упоминали о двух точках пересечения этого пути с гликолизом на этапах образования 3-ФГА и фруктозо-6-фосфата. Все это говорит о тесном контакте окислительного пентозофосфатного пути с гликолизом и о возможном переключении с одного пути на другой. Наконец, помимо пентоз, образующихся на начальных этапах пути, возникновение C4- и C7-сахаров в транскетолазной и трансальдолазной реакциях также представляет определенный интерес для клетки, так как эти сахара являются исходными субстратами для синтеза ряда важных клеточных метаболитов.
ГЕТЕРОФЕРМЕНТАТИВНЫЕ МОЛОЧНОКИСЛЫЕ БАКТЕРИИ
К гетероферментативным молочнокислым бактериям, сбраживающим сахара с образованием молочной кислоты, CO2, этанола и/или уксусной кислоты, относятся представители рода Leuconostoc и бактерии, объединенные в подрод Betabacterium рода Lactobacillus (L. fermentum, L. brevis). У них отсутствует ключевой фермент гликолитического пути — фруктозодифосфатальдолаза, и поэтому сбраживание субстратов они могут осуществлять только по окислительному пентозофосфатному пути, т. е. являются облигатно гетероферментативными формами. Кроме того, представители подрода Streptobacterium (L. casei, L. plantarum, L. xylosis) этого же рода сбраживают гексозы по гликолитическому пути, а пентозы по окислительному пентозофосфатному пути, осуществляя в первом случае гомоферментативное, а во втором — гетероферментативное молочнокислое брожение.
Таблица 18. Характеристика таксономических групп гетероферментативных молочнокислых бактерий*
| Род и подрод бактерий | Морфология и особенности клеточного деления | Молекулярное содержание ГЦ в ДНК, % | Конфигурация молочной кислоты | Наиболее распространенные виды |
| Род Leuconostoc | сферические или чечевицеобразные клетки; делятся в одной плоскости, в результате образуются цепочки | 38—44 | D | L. mesenteroides L. lactis |
| Род Lactobacillus Подрод Betabacterium | палочки; делятся в одной плоскости | 37—53 | DL | L. fermentum L. brevis L. buchneri |
* Характеристика представителей подрода Streptobacterium приведена в табл. 15.
Гетероферментативные молочнокислые бактерии по морфологическим, культуральным признакам, особенностям конструктивного метаболизма близки к гомоферментативным формам. Некоторые признаки гетероферментативных молочнокислых бактерий представлены в табл. 18.
ПУТЬ ЭНТНЕРА — ДУДОРОВА
Общая схема третьего пути расщепления углеводов эубактериями представлена на рис. 67.
Первые два его этапа — фосфорилирование молекулы глюкозы и ее дегидрирование до 6-фосфоглюконовой кислоты — идентичны первым двум этапам окислительного пентозофосфатного пути. Специфичны для пути Энтнера — Дудорова две следующие реакции: 1) дегидратирование 6-фосфоглюконовой кислоты, приводящее к образованию КДФГ-кислоты; 2) расщепление продукта первой реакции на два C3-фрагмента. Конечными продуктами второй реакции являются пировиноградная кислота и 3-ФГА. Последний окисляется в пировиноградную кислоту так же, как в гликолитическом пути. Следовательно, при разложении молекулы глюкозы до пирувата по пути Энтнера — Дудорова образуется 1 молекула АТФ (2 молекулы АТФ синтезируются на отрезке пути 3-ФГА пировиноградная кислота минус 1 молекула АТФ, затраченная на фосфорилирование глюкозы), 1 молекула НАД-H2 и 1 молекула НАДФ-H2.
Путь Энтнера — Дудорова имеет важное значение, когда сбраживаемыми субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные. Он функционирует у довольно широкого круга эубактерии, главным образом, грамотрицательных, получающих энергию в процессе дыхания (энтеробактерии50, виды Azotobacter, Pseudomonas, Alcaligenes, Rhizobium, Spirillum, Xanthomonas, Thiobacillus и др.). У анаэробов он встречается довольно редко. В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis. Однако ее изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен у некоторых клостридиев, что еще раз подчеркивает неоднородность эубактерий, объединенных в эту таксономическую группу.
50 У энтеробактерий гликолитический и окислительный пентозофосфатный пути функционируют как центральные конститутивные пути метаболизирования углеводов, путь Энтнера — Дудорова — как индуцибельный.
Согласно существующим представлениям путь Энтнера — Дудорова сформировался позднее гликолитического и окислительного пентозофосфатного путей и возник как ответвление последнего, поскольку начала окислительного пентозофосфатного пути и пути Энтнера — Дудорова идентичны и для последнего необходимо было сформировать только два новых фермента (6-фосфоглюконатдегидратазу и КДФГ-альдолазу). Появление пути Энтнера — Дудорова, вероятно, было вызвано высокой потребностью клеток в пирувате, поэтому возникла необходимость сформировать механизм, при помощи которого пируват образовывался бы из исходного субстрата как можно более коротким и прямым путем. Действительно, к получению пирувата по пути Энтнера — Дудорова ведут всего 4 реакции, в то время как в гликолитическом пути для этого требуется 9 ферментативных преобразований.
Как можно видеть из схемы процесса (рис. 67), путь Энтнера — Дудорова имеет несколько точек пересечения с гликолитическим и окислительным пентозофосфатным путями: 6-фосфоглюконовая кислота представляет собой промежуточное соединение пути Энтнера — Дудорова и окислительного пентозофосфатного; пируват и 3-ФГА — промежуточные соединения пути Энтнера — Дудорова и гликолиза.
В природе есть много мест с полным или почти полным отсутствием молекулярного кислорода. Это глубокие слои воды, почвы, илы морей и континентальных водоемов. Особую экологическую нишу для развития анаэробов представляют рубец и кишечник животных и человека. Облигатно анаэробный способ существования широко распространен среди эубактерий. Систематическое изучение анаэробных эубактерий, предпринятое в последние десятилетия, обнаружило неоднородность входящих в эту группу организмов, способных получать энергию в процессах брожения, фотосинтеза и анаэробного дыхания.
Только небольшая часть облигатно анаэробных эубактерий может быть отнесена к первичным анаэробам, т. е. возникшим в докислородную эпоху и сохранившим до настоящего времени основные черты метаболизма того периода в результате обитания в анаэробных экологических нишах: получение энергии в процессе брожения, отсутствие электронтранспортных цепей, слабо развитые биосинтетические способности.
Большинство существующих облигатных анаэробов среди эубактерий имеют вторичное происхождение как следствие повторной адаптации к анаэробным условиям, сопровождающейся, как правило, изменениями деградационного характера: потерей способности взаимодействовать с O2, утратой некоторых компонентов переноса электронов, большей зависимостью от готовых органических соединений среды обитания и т. д. Примером могут служить строго анаэробные эубактерии, составляющие основную микрофлору рубца и пищеварительного тракта животных и человека. Это в большинстве грамотрицательные кокки или палочки, способные сбраживать сахара и/или аминокислоты. У многих из них обнаружены цитохромы b и a и показана способность синтезировать АТФ по механизму мембранзависимого фосфорилирования.
В представленном в этой главе материале проанализированы энергетические процессы, сформированные на первом этапе эволюции жизни на Земле. То, что брожение — наиболее примитивный способ получения энергии организмами, в настоящее время никем не ставится под сомнение. Гораздо сложнее оценить, какой путь в процессе эволюции пройден теми или иными организмами. Очевидно, что при имеющихся возможностях обмена генетической информацией в мире прокариот сохранение их в первоначальном виде маловероятно. Описание представленных в этой главе нескольких групп анаэробных эубактерий, в первую очередь, пропионовокислых бактерий и клостридиев, служит иллюстрацией этого.
| 
| 
| 
| 
|
| Назад | Главная страница | Оглавление | Вниз | Вперед |
ГЛАВА 14. ФОТОСИНТЕЗ. ТИПЫ ЖИЗНИ, ОСНОВАННЫЕ НА ФОТОФОСФОРИЛИРОВАНИИ
В предыдущей главе был рассмотрен ряд групп прокариот, относящихся к эубактериям, получающих энергию в реакциях субстратного фосфорилирования и не зависящих от молекулярного кислорода. Их предки появились на Земле, когда в ее атмосфере отсутствовал O2. Единственным источником свободной энергии, доступным первобытным организмам, была химическая энергия органических молекул, возникших в основном абиогенным путем. Увеличение численности популяций приводило к возрастанию использования органических молекул в окружающей среде, которое на определенном этапе стало превышать их накопление. В результате органические вещества постепенно исчерпывались из среды. Создавалась критическая ситуация, вызываемая нехваткой соединений, которые могли бы служить источником свободной энергии для организмов. Перед ними возникла проблема поиска новых источников углеродного питания и свободной энергии. В энергетическом плане необходимо было найти способ получения энергии за счет постоянно действующего источника. Такой источник энергии представляет собой солнечная радиация. Глобальное значение развившейся способности использовать световую энергию в том, что фотосинтез — единственный процесс, приводящий к увеличению свободной энергии на нашей планете. Таким образом, фотосинтез обязан своим "происхождением" экологическому кризису, возникшему в результате исчерпания на определенном этапе развития жизни органических ресурсов планеты.
Жизнь за счет анаэробных превращений органических субстратов привела к возникновению анаэробной формы жизни за счет света. Для этого прежде всего должны были возникнуть молекулы, поглощающие кванты света. Когда сформировались структуры для улавливания света, появилась возможность использования световой энергии. То, как эта возможность реализовывалась, доказывает наличие нескольких типов фотосинтеза, осуществляемого разными группами эубактерий, энергетический метаболизм которых полностью или частично основан на использовании энергии света. Фотосинтезирующие эубактерий представлены пурпурными и зелеными бактериями, гелиобактериями, цианобактериями51 и прохлорофитами.
51 В ботанической литературе — сине-зеленые водоросли.
ПИГМЕНТЫ ФОТОСИНТЕЗИРУЮЩИХ ЭУБАКТЕРИЙ
Для абиогенного синтеза органических веществ в основном требовался ультрафиолет. Все известные в настоящее время фотосинтезирующие организмы используют в процессе фотосинтеза видимый и инфракрасный свет. Наиболее богатые энергией ультрафиолетовые лучи в фотосинтезе практически не используются (см. рис. 35). Это связано с фотохимическими эффектами разных частей спектра, рассмотренными ранее.
Фотосинтезирующие эубактерий обязательно содержат магнийпорфириновые пигменты — хлорофиллы. Известно больше десяти видов хлорофиллов, но все они поглощают свет видимой и инфракрасной частей спектра.
Вероятно, первыми фоторецепторами, предшественниками современных хлорофиллов, следует считать порфирины, структура которых обеспечивает поглощение умеренно энергизованных квантов света. Экспериментально показана возможность синтеза порфиринов абиогенным путем из простых веществ в условиях, имитирующих условия первобытной Земли.
Важным моментом в эволюции порфиринов явилось включение ионов металла в центр порфиринового ядра. Все порфирины, обладающие фоторецепторным действием, являются магниевыми комплексами. Порфирины, участвующие в темновом транспорте электронов (цитохромы), а также ферменты каталаза и пероксидаза содержат в центре порфиринового кольца атом железа.
Итак, способность организмов существовать за счет энергии света в первую очередь связана с наличием у них специфических фоторецепторных молекул — пигментов. Набор пигментов характерен и постоянен для определенных трупп фотосинтезирующих эубактерий. Соотношения между отдельными пигментами колеблются в зависимости от вида и условий культивирования. В целом фотосинтетические пигменты эубактерий обеспечивают поглощение света с длиной волны в области 300 — 1100 нм.
Все фотосинтетические пигменты относятся к двум химическим классам соединений: 1) пигменты, в основе которых лежит тетрапиррольная структура (хлорофиллы, фикобилипротеины); 2) пигменты, основу которых составляют длинные полиизопреноидные цепи (каротиноиды). Особенность химического строения молекул всех фотосинтетических пигментов состоит в наличии системы сопряженных двойных связей52, от количества которых зависит способность пигментов улавливать бедные энергией кванты света, а также защита каротиноидами хлорофилла от синглетного кислорода.
52 Сопряженными называются двойные связи, чередующиеся с простыми, т. e. -CH=CH-СH=CH-.
 2015-06-16
2015-06-16 919
919








