Большинство химических реакций является обратимыми, т.е. они протекают одновременно в двух противоположных направлениях – прямом (®) и обратном (), например:
N2(г) + 3Н2(г) «2NH3(г)
Состояние системы, при котором скорости прямой и обратной реакций равны, называется химическим равновесием. В состоянии равновесия концентрации реагентов и продуктов постоянны; их называют равновесными и обозначают квадратными скобками [ ].
Для приведенной реакции условие химического равновесия запишется так:
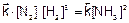
Любое химическое равновесие количественно характеризуется константой равновесия – это отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам. Для реакции в общем виде:
aA + bB «dD + fF
константа химического равновесия, выраженная через молярные концентрации веществ, запишется так:
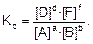 (1)
(1)
Уравнение (1) является выражением закона действия масс для обратимых реакций.
Если реакция протекает в газовой фазе, то константа равновесия рассчитывается через равновесные парциальные давления. Например, для вышеприведенной реакции синтеза аммиака:
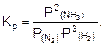 (2)
(2)
Константа равновесия зависит от природы реагирующих веществ, температуры, но не зависит от концентрации реагентов. Значение константы равновесия определяет глубину превращения исходных веществ в продукты реакции. При Кс>>1 равновесие обратимой реакции смещено в сторону прямой реакции, т.е. реакция дает большой выход продуктов. При Kc<<1 выход продуктов очень мал и равновесие смещено в сторону исходных веществ.
Каждое химическое равновесие устанавливается при определенных условиях: концентрациях, температуре, давлении для газов. Изменение одного из параметров приводит к нарушению и смещению равновесия. Направление смещения равновесия определяется правилом Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие системы сместится в сторону той реакции, которая ослабляет это воздействие.
1. При уменьшении концентрации одного из веществ равновесие смещается в сторону реакции, которая образует это вещество. При увеличении концентрации вещества равновесие смещается в сторону реакции, которая расходует это вещество.
2. Повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение – в сторону экзотермической реакции.
3. Изменение давления оказывает влияние на равновесие в том случае, если в реакции участвуют газообразные вещества. При повышении внешнего давления равновесие смещается в сторону той реакции, которая сопровождается уменьшением количества газообразных веществ, т.е. уменьшением объема. Наоборот, при понижении внешнего давления равновесие смещается в сторону увеличения количества газообразных веществ, т.е. увеличения объема.
Пример 1. При синтезе аммиака
N2(г) + 3Н2(г) «2NH3(г)
Равновесие установилось при следующих концентрациях реагирующих веществ, моль/л:
[N2]=2,5; [H2]=1,8; [NH3]=3,6.
Рассчитайте константу равновесия этой реакции и начальные концентрации азота и водорода.
 2015-06-04
2015-06-04 958
958








