Карбонилами металлов называют химические соединения металлов с группами (лигандами) СО. Схематически карбонильный метод (карбонил-процесс) получения порошков может быть представлен как химическая транспортная реакция:
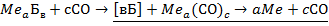 , (3.92)
, (3.92)
где Ме - переходный металл V-VIII групп периодической системы; Б - балластные вещества (кислород, солевой остаток, примеси и т.п.); а, в, с - коэффициенты, численные значения которых зависят от природы Ме.
| 0 |
| 0 |
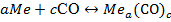 . (3.93)
. (3.93)
В его первой фазе (синтез) реакция идет слева направо с образованием карбонила металла и является всегда экзотермической; во второй фазе процесса (термическое разложение, т.е. диссоцация) реакция идет справа налево с образованием металла и СО и всегда эндотермична.
При синтезе на поверхности исходного материала сначала происходит адсорбция газообразных молекул СО (физическая адсорбция), сопровождающаяся относительно небольшим тепловым эффектом; адсорбированный газ может быть десорбирован без особого труда. Затем накапливающиеся молекулы СО создают адсорбированный слой (активированная адсорбция), в котором внутренние связи адсорбированных молекул деформируются, начинается их химическое взаимодействие с металлом с образованием молекул соответствующего карбонильного соединения, которые вначале остаются на поверхности исходного материала (физическая адсорбция), удерживаемые силами ван-дер-вальсового сцеп ления.
Активированная адсорбция СО протекает значительно медленнее физической адсорбции Меа (СО) с, поэтому почти весь адсорбционный слой постепенно заполняется молекулами карбонила. Из-за этого доступ СО к реакционной поверхности исходного материала Меа Б в, (его наружная габаритная поверхность, трещины и поры) все более затрудняется. Может наступить момент, когда доступ СО совсем прекратится и процесс образования карбонила остановится. По мере извлечения металла Ме в карбонильную фазу трещины и поры в объеме исходного материала Меа Б в углубляются, что соответственно затрудняет доступ СО к обновляющейся поверхности. Десорбция молекул образующегося карбонила также происходит гораздо легче с внешней габаритной поверхности исходного материала, чем из глубокой узкой трещины или поры в нем. Таким образом, процесс образования карбонила Меа (СО) с оказывается тесно связанным с диффузионными процессами: с диффузией СО из газовой фазы к поверхности твердого тела и с диффузией молекул образующегося карбонила из глубины твердого тела к его поверхности, а затем в газовую фазу.
Эффективная площадь поперечного сечения всех трещин и пор у исходного твердого материала Меа Б в непрерывно увеличивается по мере извлечения металла Ме со стенок пор и трещин в карбонильную фазу. По тем же причинам она не остается равномерной (при прочих равных условиях) по длине пути, будучи наибольшей у поверхности частиц (куска) материала и наименьшей у места, до которого проникли молекулы СО в данный момент. Изменение Площади поперечного сечения пор во времени зависит от многих причин: от состава исходного твердого материала, термической обработки, условий синтеза карбонила и др.
| 0 |
Строение карбонилов металлов объяснимо только с помощью координационной теории, разработанной для комплексных соединений, так как многочисленные попытки объяснить структуру карбонилов металлов в соответствии с положениями, правильными для классических типов связей (ионной, полярной и неполярной), не дали положительных результатов. В карбонилах металлов, являющихся координационными соединениями, группа СО как донор электронов занимает одно координационное место и присоединяется через атом углерода непосредственно к металлу координативной одинарной связью. Химическая связь в карбонилах металлов обусловливается сближением атомов металла с атомами углерода лигандов СО. Движение электронов в этих атомах изменяется в сторону увеличения электронной плотности в пространстве между ними с одновременным частичным обобществлением электронов, так как они становятся общими для атомов металла и углерода.
Карбонилы металлов могут быть моно- и полиядерными. Н. Сиджвик предложил использовать понятие эффективного атомного номера (ЭАН - число электронов в конфигурации атома инертного газа, замыкающего тот ряд периодической системы элементов, в котором помещается соответствующий металл, образующий карбонил) для описания строения истинных карбонилов: разность между ЭАН и атомным номером металла показывает количество электронов, которое необходимо приобрести металлуакцептору у лигандов СО (доноров). Приобретая недостающие электроны, атом металла-комплексообразователя притягивает к себе соответствующее количество лигандов СО, образуя устойчивое соединение с электронной структурой, подобной стоящему за ним ближайшему инертному газу.
Н. Сиджвик и Р. Бейли предложили уравнение для определения формулы карбонилов металлов Меа (СО) с:
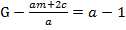 ;
; 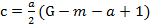 ,
,
где т - атомный номер переходного металла V-VIII групп; G атомный номер ближайшего инертного газа.
В целом в карбонилах металлов возможно существование четырех типов связей:
1) координационно-ковалентная связь Ме- СО, при которой атом С отдает металлу электронную пару (σ-связь) и дополнительно связывается с металлом обратной -связью с участием d -электронов металла;
2) ковалентная связь Ме-Ме в биметаллических карбонилах, при которой каждый атом металла поставляет для связи один электрон;
3) ковалентная σ-связь между металлом и СО, причем атом С служит мостиком между двумя атомами металла, образуя связь с каждым из них;
4) в карбонилах типа Ме 6(СО)16 имеется связь Ме -СО, при которой СО служит мостиком между тремя атомами металла; эти карбонилы не подчиняются правилу ЭАН.
По структурному признаку карбонилы металлов можно разделить на одноядерные и многоядерные:
1) одноядерные - с одним атомом металла в молекуле, например Fe(CО)5, Ni(CО)4, Ме (СО)6 и др.;
2) многоядерные формулы Меа (СО) с: монометаллические – с двумя или более одинаковыми атомами металла в молекуле, например Со2(СО)8, Fe2(CО)9, Fe3(CО)12 и др.; полиметаллические - с двумя или более разными атомами металлов в молекуле, например Mn2Fe(CO)14, FeRu(CO)12, MnReFe(CO)14 и др.; смешанные- с атомами металлов и неметаллов, например CFe5(CO)15, CRu6(CO)17, SCo(CO)9 и др.
Установлено, что Fe3(CO)12 содержит два типа атомов железа в соотношении 2:1, т.е. три атома железа в молекуле карбонила не могут быть эквивалентны. Таким образом, в случае полиядерных карбонилов каждый из атомов металла не обязательно должен быть эквивалентен друг другу и может располагаться на различных расстояниях от условного центра.
Строение карбонилов металлов и особая природа связи между атомами металлов и лигандов СО предопределяют их специфические свойства, среди которых наиболее важна легколетучесть. Летучесть карбонилов обусловлена атомной конфигурацией их молекул, расположением электрического поля в каждой молекуле и зависит от сил сцепления молекул между собой.
Распад молекул карбонила приводит в первый момент к появлению атомов металла и газообразных молекул СО. Дальнейшее формирование агрегатов (частиц) всегда начинается с кристаллизации парообразного металла, состоящей из двух этапов: сначала образуются зародыши, а затем, когда зародыши достигнут критического размера 4-20 нм, формируются металлические частички (агрегаты, кристаллы) за счет термического распада на поверхности зародышей оставшихся паров карбонила.
На скорость образования зародышей в единице объема и на скорость формирования металлических кристаллов влияют степень разрежения в аппарате, плотность (концентрация) паров образующегося металла и, главным образом, температура: при относительно низкой температуре образуется значительно меньше зародышей, чем при повышенной, а увеличение плотности пара металла и более глубокое разрежение в аппарате благоприятствует образованию зародышей.
Рисунок 38- Зависимость величины Δ  от температуры
от температуры
для реакций термораспада карбонилов металлов: 1 -Ni(CO)4; 2 -Fe(CO)5; 3 -Cr(CO)6; 4 -Mo(CO)6;
5 -W(CO)6; 6 -Co2(CO)8; 7 -Mn2(CO)10; 8 -Re2(CO)10; 9 -Os3(CO)12
Условия развития зародышей значительно отличаются от условий их образования, хотя скорость роста кристаллов также зависит от температуры процесса и плотности паров металла. В условиях глубокого вакуума образуются настолько мелкие частицы, что практически они осаждаются на внутренней стенке реактора в виде блестящего металлического зеркала, причем кристаллы приобретают правильно сформированные грани. В умеренном вакууме образуется смесь правильных кристаллов самых различных размеров, а в неглубоком вакууме появляются дендриты. Вначале при кристаллизации происходит адсорбция паров металла на поверхности зародыша (частицы). За счёт выделяющейся теплоты адсорбции температура внешней поверхности металлического зародыша- частички всегда выше температуры окружающей среды. Адсорбированный металлический атом на поверхности металлического зародыша сохраняет подвижность по двум направлениям. Чем выше температура адсорбционного слоя, т.е. поверхности зародыша, тем выше подвижность адсорбированного атома, тем легче он достигает свободного узла кристаллической решетки и тем легче образуется кристалл с правильными гранями.
В верхней зоне реактора (аппарата-разложителя) субмикроскопическая частичка металла сталкивается в газовом потоке со множеством атомов металла, молекул карбонила и оксида углерода и адсорбирует их на своей поверхности. Атомы металла, находясь в адсорбированном слое и сохраняя свободу перемещения в двух направлениях, стремятся занять свободные узлы в кристаллической решетке. Молекулы карбонила в момент соударения с перегретой поверхностью частички получают дополнительный тепловой импульс для немедленной диссоциации. Молекулы оксида углерода на перегретой активной поверхности металлической частички находятся в условиях, наиболее благоприятных для их распада по схеме 2СО  С + СО2 (реакция Белла-Будуара; железо действует как катализатор). В итоге всех этих процессов кристаллик непрерывно растет, но этот рост носит скачкообразный характер и перемежается с отложением сажи и адсорбционных включений. Этим объясняется строение частичек некоторых карбонильных порошков, например железных, называемое «луковой кожурой».
С + СО2 (реакция Белла-Будуара; железо действует как катализатор). В итоге всех этих процессов кристаллик непрерывно растет, но этот рост носит скачкообразный характер и перемежается с отложением сажи и адсорбционных включений. Этим объясняется строение частичек некоторых карбонильных порошков, например железных, называемое «луковой кожурой».
Средний размер частичек карбонильного порошка определяется следующими факторами. В верхней зоне аппарата-разложителя зародыши-частички очень малы. Поступательная скорость частичек определяется общей скоростью газового потока, движущегося обычно сверху вниз. Однако истинный путь зародышей в сотни тысяч раз больше пути газового потока, и это создает благоприятные условия для столкновения между отдельными зародышами частичками и атомами металла, что приводит к постепенному укрупнению металлического кристалла. По мере укрупнения частички начинает проявляться ее сила тяжести, направленная, как и общее движение газового потока в аппарате, сверху вниз. Истинный путь, проходимый частичкой за единицу времени, начинает резко уменьшаться. Следовательно, средний размер частички карбонильного порошка зависит не только от температуры и длины горячей зоны, но и от скорости газового потока, концентрации паров металла и зародышей и собственной массы частички. Частичка, свободно падающая в данной среде под действием собственной массы, фактически более не увеличивается в размере, так как быстро уходит из реакционной зоны.
Кристаллизация металла может существенно измениться, если поверхность растущего кристаллика подвергнуть тепловым, химическим или физическим воздействиям. Например, если пары карбонила разлагать в атмосфере постороннего газа, то образующиеся пары металла (а затем и его зародыши) окажутся окруженными молекулами этого газа-разбавителя. Формирующиеся частички металла, сталкиваясь с огромным количеством молекул постороннего газа, адсорбируют эти молекулы на своей поверхности. Наоборот, столкновение частички с парами металла и с молекулами карбонила в этих условиях затрудняется, вследствие чего замедляется рост зародышей металла и карбонильные порошки получаются более мелкими.
При разбавлении паров карбонила любым газом необходимо иметь в виду физико-химическое воздействие, которое разбавитель может оказать на формирующийся кристаллик в горячей зоне разложителя. Поэтому инертные газы-разбавители следует различать не только по их активности в отношении, например, степени измельчения карбонильного металлического порошка, но также по воздействию на форму частичек и внесению примесей в готовый продукт. Например, ввод в аппарат водорода приводит к разбавлению газовой фазы и, в результате, к значительному понижению крупности образующихся частиц, но вместе с этим при наличии активного высокодисперсного порошка в аппарате создаются благоприятные условия для протекания реакции Ме + СО + Н2  Ме С+Н2О, что приводит к повышению содержания углерода в полученном порошке.
Ме С+Н2О, что приводит к повышению содержания углерода в полученном порошке.
Карбонильный метод отличают наибольшая универсальность при необходимости получения разнообразных модификаций металлов, образующих высоколетучие карбонилы, в том числе в особо чистом состоянии, и возможность прямого получения многих композиций металлов, а также композиций с присадкой легирующих неметаллических элементов. В промышленных масштабах карбонил- процесс используют для производства никеля, железа, кобальта, вольфрама, хрома, молибдена и некоторых металлов платиновой группы.
Наибольшее практическое значение в настоящее время карбонильный метод имеет для получения порошков никеля и железа карбонилы которых Ni(CО)4 и Fe(CО)5 были получены соответственно в 1888г. и 1891г.
В 1902 г. в Англии (г.Клайдах, Южный Уэльс) началось промышленное производство карбонильного никеля (метод Л.Монда), при котором синтез и термическое разложение карбонила ведут при давлении, близком к атмосферному, и температурах 50-60 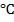 и 200-250
и 200-250  соответственно. Исходным сырьем в процессе служит медно-никелевый штейн (CuS-NiS-FeS), а конечный продукт - карбонильный никель Монда - представляет собой гранулы диаметром 5-10 мм, содержание никеля в которых 99,5- 99,8 %. В настоящее время производство составляет до 25000 т/год.
соответственно. Исходным сырьем в процессе служит медно-никелевый штейн (CuS-NiS-FeS), а конечный продукт - карбонильный никель Монда - представляет собой гранулы диаметром 5-10 мм, содержание никеля в которых 99,5- 99,8 %. В настоящее время производство составляет до 25000 т/год.
В 30-х годах ХХ в. фирма «И.Г. Фарбениндустри» (Германия) разработала и реализовала технологию, пригодную для получения порошков никеля с размером частиц до 20 мкм и железа; в качестве исходного сырья использовали соответственно никелевый файнштейн или губку железа. Принципиальная схема этого процесса применительно к получению порошка никеля показана на рис. 39. Реакционный газ (95 % СО и 5 % Н2) подают подогретым до 150-200  в колонну синтеза 4 (цилиндр высотой 9-12 м и диаметром 0,7-1,0 м со стенками толщиной 10-15 см, вмещающий 18-20 т никельсодержащего материала). Начальное давление газа 5-10МПа, но по мере обеднения файнштейна никелем давление и температуру газа повышают соответственно до 20 МПа и 250
в колонну синтеза 4 (цилиндр высотой 9-12 м и диаметром 0,7-1,0 м со стенками толщиной 10-15 см, вмещающий 18-20 т никельсодержащего материала). Начальное давление газа 5-10МПа, но по мере обеднения файнштейна никелем давление и температуру газа повышают соответственно до 20 МПа и 250  .
.
Рисунок 39 - Схема получения порошка карбонильного никеля: 1 - газгольдер с СО;
2 -компрессор; З - ресивер; 4 - колонна синтеза карбонила;
5 - циркуляционный насос; 6 - холодильник; 7 - сборник сконденсированного карбонила
под высоким давлением; 8 - сборник сырого карбонила;
9 - ректификационная колонна; 10 - сборник-испаритель готового карбонила;
11 - разложитель (диссоциатор) карбонила
Образовавшийся при синтезе карбонил конденсируется в холодильнике 6, из которого СО циркуляционным насосом возвращают в колонну синтеза (куда периодически поступают и свежие порции газа), а сырой карбонил стекает последовательно в ряд сборников, где давление постепенно понижается до 0,5 МПа. Для удаления примесей (паров воды, смазки от уплотнений компрессора и насоса) карбонил подвергают дистилляции в ректификационной колонне 9. Диссоциацию карбонила никеля проводят при нормальном давлении и температуре 250-400  в колоннах разложения (цилиндрических реакторах высотой 5 м и диаметром 1м), куда его пары поступают в количестве 50-200 кг/ч из змеевикового испарителя 10. Например, завод в г. Оппау (ФРГ) производил в 60-х годах ХХ в. до 6000 т порошка карбонильного никеля в год.
в колоннах разложения (цилиндрических реакторах высотой 5 м и диаметром 1м), куда его пары поступают в количестве 50-200 кг/ч из змеевикового испарителя 10. Например, завод в г. Оппау (ФРГ) производил в 60-х годах ХХ в. до 6000 т порошка карбонильного никеля в год.
Около тридцати лет назад в Канаде (г. Коппер-Клиф) постро ен завод по производству 45 тыс.т/год никелевой дроби и 11,5 тыс.т/год карбонильных порошков никеля, железа и их сШiавов. Синтез карбонила металла ведут при давлении 7 МПа и темпера туре 180 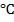 в течение 42 ч в реакторе вращающегося типа. Разложение карбонила осуществляют аналогично рассмотренному выше.
в течение 42 ч в реакторе вращающегося типа. Разложение карбонила осуществляют аналогично рассмотренному выше.
В бывшем СССР в системе цветной металлургии с середины 50-х до начала 90-х гг. ХХ в., а затем в РФ осуществляется производство карбонильного никеля; для синтеза тетракарбонила никеля используют высокое давление СО, а термическое разложение Ni(CО)4 проводят как описано выше. По ГОСТ 9722-97 никелевый порошок должен соответствовать одной из четырех марок по химическому составу: ПИК-У (Ni 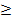 99,9 %), ПИК-0 (Ni
99,9 %), ПИК-0 (Ni 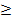 99,90 %), ПНК- 1 (Ni
99,90 %), ПНК- 1 (Ni 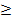 99,70 %) и ПНК-2 (Ni
99,70 %) и ПНК-2 (Ni 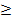 99,70 %). Для характеристики насыпной плотности порошка выделяют три группы: Т - тяжелый, Л - легкий, К - крупнозернистый; каждая из этих групп подразделяется на подгруппы: Т - 1, 2, 3, 4; Л- 5, 6, 7, 8; К - 9, 10. Пример полного обозначения марки никелевого порошка: ПИК-ОП.
99,70 %). Для характеристики насыпной плотности порошка выделяют три группы: Т - тяжелый, Л - легкий, К - крупнозернистый; каждая из этих групп подразделяется на подгруппы: Т - 1, 2, 3, 4; Л- 5, 6, 7, 8; К - 9, 10. Пример полного обозначения марки никелевого порошка: ПИК-ОП.
Размер частиц порошка группы Т или Л должен быть < 20 мкм, для порошка ПНК-2К9 -от 71 до 100 мкм, а для порошка ПНК- 2К10 - от 45 до 71 мкм. Насыпная плотность порошка для под групп с 1 по 8 уменьшается с 3,0-3,5 г/см3 до 0,45-0,60 г/см3, для подгруппы 9 составляет 1,3-1,7 г/см3, а для подгруппы 10 -1,20 г/см3. Масса партии карбонильного никелевого порошка должна быть 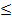 10т. Упаковывают порошок в полиэтиленовую или металлическую тару, срок хранения в закрытых сухих отапливаемых помещениях при температуре воздуха от 0 до 35
10т. Упаковывают порошок в полиэтиленовую или металлическую тару, срок хранения в закрытых сухих отапливаемых помещениях при температуре воздуха от 0 до 35 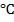 - 36 мес.
- 36 мес.
В середине 20-х годов в Германии, с конца 30-х годов в бывшем СССР и в 40-х годах ХХ в. в США и Англии организован промышленный выпуск карбонильных железных порошков, суммарное производство которых в настоящее время превышает, по-видимому, 30 тыс.т/год.
Рисунок 40 - Схема синтеза пентакарбонила железа (а) и получения порошка карбонильного железа (б)
Синтез карбонила Fe(CО)5 ведут в соответствии со схемой, приведенной на рис. 40, а. Дробленое железосодержащее сырье (губчатое железо, штейн, некоторые оксидные железные руды, скрап, стружка и др.) в виде кусков размером 10-25 мм загружают в колонну синтеза 4, выполненную из легированной стали и рассчитанную на рабочее давление около 20 М Па и температуру до 250 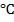 . По окончании загрузки исходного сырья вся система опрессовывается сжатым азотом до давления 20 МПа, после чего азот сбрасывают в атмосферу. В нижнюю часть колонны 4 подают сжатый оксид углерода из сборника 2, где он хранится под давлением до 32,5 МПа. После заполнения системы до давления СО 5-10 МПа включают циркуляционный насос 10, обеспечивающий движение реакционного газа через слой загруженного в колонну 4 железосодержащего сырья. По мере расходования СО на синтез карбонила железа производится периодическая подача газа в систему из сборника 2. Циркулирующий в системе реакционный газ очищается от масла в маслоотделителе 1 (стальной емкости, снабженной штуцерами входа и выхода газа и слива масла) и подогревается до 80-170 ·с в теплообменнике 3 типа «труба в трубе». Так как реакция образования Fe(CО)5 экзотермична, рабочая температура в колонне 4 после начала циркуляции сжатого газа поддерживается за счет тепловыделения при взаимодействии железа и СО. В конце синтеза карбонила температуру и давление газа в колонне поддерживают на верхнем пределе, что улучшает полноту использования исходного сырья. Во время синтеза концентрация СО в циркулирующем газе поддерживается не ниже 80 %. На ход синтеза благоприятно влияют примеси аммиака, водорода, сероводорода и некоторых спиртов при их непродолжительном воздействии. Образующиеся пары пентакарбонила железа вместе с непрореагировавшим СО очищают от пыли в фильтре 5, снабженном змеевиком для обогрева паром (предотвращается конденсация паров карбонила) и тканевым рукавом для фильтрации газа. Очищенный газ поступает в холодильник-конденсатор 6, где охлаждается, а пентакарбонил железа конденсируется и охлаждается до 60 °С. Отделение жидкого карбонила железа от циркуляционного газа проводят в сифонном сепараторе 7,.после которого СО проходит через ловушку в фильтр высокого давления для улавливания механических загрязнений и поступает на всасывание в циркуляционный насос 10. Жидкий карбонил железа из сепаратора 7 направляется в десорбер (на рис. не показан), где происходит выделение растворенного в нем СО, затем поступает в сборник 8, проходит через фильтр 9 и идет в емкость продукта 11 (рис. 40, б). Окончание синтеза карбонила определяют по прекращению его поступления в сепаратор в течение 30 мин. После окончания процесса продолжается циркуляция газа для охлаждения колонны синтеза примерно до 70
. По окончании загрузки исходного сырья вся система опрессовывается сжатым азотом до давления 20 МПа, после чего азот сбрасывают в атмосферу. В нижнюю часть колонны 4 подают сжатый оксид углерода из сборника 2, где он хранится под давлением до 32,5 МПа. После заполнения системы до давления СО 5-10 МПа включают циркуляционный насос 10, обеспечивающий движение реакционного газа через слой загруженного в колонну 4 железосодержащего сырья. По мере расходования СО на синтез карбонила железа производится периодическая подача газа в систему из сборника 2. Циркулирующий в системе реакционный газ очищается от масла в маслоотделителе 1 (стальной емкости, снабженной штуцерами входа и выхода газа и слива масла) и подогревается до 80-170 ·с в теплообменнике 3 типа «труба в трубе». Так как реакция образования Fe(CО)5 экзотермична, рабочая температура в колонне 4 после начала циркуляции сжатого газа поддерживается за счет тепловыделения при взаимодействии железа и СО. В конце синтеза карбонила температуру и давление газа в колонне поддерживают на верхнем пределе, что улучшает полноту использования исходного сырья. Во время синтеза концентрация СО в циркулирующем газе поддерживается не ниже 80 %. На ход синтеза благоприятно влияют примеси аммиака, водорода, сероводорода и некоторых спиртов при их непродолжительном воздействии. Образующиеся пары пентакарбонила железа вместе с непрореагировавшим СО очищают от пыли в фильтре 5, снабженном змеевиком для обогрева паром (предотвращается конденсация паров карбонила) и тканевым рукавом для фильтрации газа. Очищенный газ поступает в холодильник-конденсатор 6, где охлаждается, а пентакарбонил железа конденсируется и охлаждается до 60 °С. Отделение жидкого карбонила железа от циркуляционного газа проводят в сифонном сепараторе 7,.после которого СО проходит через ловушку в фильтр высокого давления для улавливания механических загрязнений и поступает на всасывание в циркуляционный насос 10. Жидкий карбонил железа из сепаратора 7 направляется в десорбер (на рис. не показан), где происходит выделение растворенного в нем СО, затем поступает в сборник 8, проходит через фильтр 9 и идет в емкость продукта 11 (рис. 40, б). Окончание синтеза карбонила определяют по прекращению его поступления в сепаратор в течение 30 мин. После окончания процесса продолжается циркуляция газа для охлаждения колонны синтеза примерно до 70 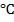 , затем СО из системы сбрасывается в атмосферу (по экологическим соображениям должна быть предусмотрена нейтрализация СО). Далее колонну синтеза продувают аргоном до полного отсутствия СО в продувочном газе и производят перегрузку колонны синтеза: остатки железосодержащего материала выгружают из колонны и загружают в нее свежую порцию исходного сырья. Так как колонна 4 работает циклически, для осуществления непрерывного производственного процесса в схеме обычно предусматривают не менее трех однотипных реакторов синтеза карбонила.
, затем СО из системы сбрасывается в атмосферу (по экологическим соображениям должна быть предусмотрена нейтрализация СО). Далее колонну синтеза продувают аргоном до полного отсутствия СО в продувочном газе и производят перегрузку колонны синтеза: остатки железосодержащего материала выгружают из колонны и загружают в нее свежую порцию исходного сырья. Так как колонна 4 работает циклически, для осуществления непрерывного производственного процесса в схеме обычно предусматривают не менее трех однотипных реакторов синтеза карбонила.
При производстве порошка железа жидкий карбонил из напорной емкости 11 (рис. 40, б) через фильтрующее 12 и дозирующее 13 устройства направляется в испаритель 14 (некоторые типы аппаратов показаны на рис. 41), в котором карбонил подогревается паром, пропускаемым через рубашку испарителя или змеевик, погруженный в жидкостъ, либо нагретым СО, проходящим через спеченный фильтр в жидкий карбонил. Пары карбонила железа из испарителя 14 через обогреваемый при помощи паровой рубашки патрубок («калач») направляют в горловину на крышке аппарата разложения 15 (его продольный разрез показан на рис. 42) и далее поступают в свободный объем этого диссоциатора, имеющего высоту 4-5 м. Снаружи аппарат разложения по всей высоте окружен теплообменной рубашкой, обеспечивающей его обогрев за счет циркуляции в ней топочных газов. Для улучшения теплообмена внутри рубашки аппарата имеются винтообразные плоскости, создающие направленное движение топочных газов. Вместо газового потока иногда применяют электрообогрев с раздельной регулировкой по зонам, соответствующим верху, середине и низу аппарата. При стандартном режиме разложение пентакарбонила железа проводят при температурах верхней зоны аппарата разложения (0,8 его высоты) t 5= 295-300 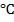 , средней зоны (0,6 его высоты) 13 = 305-310 ·с, нижней зоны (0,3 высоты) 12 = 310-345
, средней зоны (0,6 его высоты) 13 = 305-310 ·с, нижней зоны (0,3 высоты) 12 = 310-345 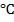 .
.
Возможны и другие температурные режимы работы диссоциатора: падающий, когда по высоте аппарата сверху вниз создают понижение температуры при градиенте температур между зонами 12-15°С; конвекционный, когда t 5= t 2= 270-280 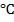 , а t 3= 280-290 °С. При падающем температурном режиме разложения карбонила получают порошки несколько чище (так как в более холодной части аппарата 15 слабее идут побочные реакции), чем при стандартном, а при конвекционном частицы более крупные, так как создаются условия для развития восходящих конвекционных потоков в диссоциаторе и увеличивается продолжительность пребывания в нем образующихся частиц железа.
, а t 3= 280-290 °С. При падающем температурном режиме разложения карбонила получают порошки несколько чище (так как в более холодной части аппарата 15 слабее идут побочные реакции), чем при стандартном, а при конвекционном частицы более крупные, так как создаются условия для развития восходящих конвекционных потоков в диссоциаторе и увеличивается продолжительность пребывания в нем образующихся частиц железа.
Рисунок 41 - Конструкция испарителей пентакарбонила железа: а - с наружной рубашкой;
б -с внутренним змеевиком; в -с барботером, через который подается СО; 1 - ввод карбонила;
2 - ввод продувочного газа; 3 - обогреваемый змеевик; 4 -обогреваемая рубашка
Термическую диссоциацию пентакарбонила железа проводят в присутствии газообразного аммиака (20-40 л газа NH3 на 1 л жидкого карбонила), который способствует образованию мелких и более чистых сферических частиц железа, уменьшая количество свободного углерода в порошке.
Рисунок 42 - Схема промышленного аппарата разложения с газовым обогревом
(t 1, t 2 ,t 3, t4,t 5- точки замера температурывнутри аппарата)
Газообразный аммиак подают через тангенциальную щель в горловине аппарата 15, на выходе из которой происходит смешивание его с парами карбонила железа. В аппарате разложения одновременно с основной реакцией диссоциации карбонила протекают и побочные реакции образования оксидов, нитридов и карбидов железа. В связи с этим частицы железа растут во взвешенном состоянии в диссоциаторе циклическими слоями и равномерно во всех направлениях. Получаемые порошинки имеют шарообразную (сферическую) форму и характеризуются слоистой («луковичной») структурой. Обычно при сформировавшихся 7-9-ти слоях масса частицы начинает превышать подъемную силу циркулирующего в диссоциаторе газа, вследствие чего порошинка оказывается в донной части аппарата 15. В порошке железа часто встречаются сростки, образованные двумя, тремя и более частицами. При температуре выше 400 °С в аппарате разложения карбонила могут образовываться волокна (сросшиеся частицы размером в поперечнике 0,2-0,3 мкм и длиной до нескольких миллиметров). В общем случае средний размер порошинки железа зависит от температуры, длины горячей зоны (чем больше, тем крупнее порошок), объемной скорости проходящего через аппарат разложения газового потока (чем выше, тем мельче частицы) и концентрации паров металла (чем меньше, тем мельче частицы).
Образовавшийся при диссоциации карбонила железа оксид углерода удаляется в рукавный фильтр 16 (от 1до12 рукавов), увлекая с собой сформировавшиеся частицы металла, не успевшие выпасть в осадок. Около 80 % порошка осаждается в приемнике аппарата разложения, 17-18 % порошка задерживается фильтром 16 (фильтр оборудован устройством, встряхивающим рукава для удаления застрявших в них частиц) и 2-3 % улавливается в соединительном коллекторе 17 и в конечном рукавном фильтре 18. После фильтра 18 СО поступает на очистку от аммиака в скруббер 19, пройдя который направляется на синтез пентакарбонила железа. При необходимости получения более мелких порошков (например, для применения в радиоэлектронике) часть отходящего СО возвращают в диссоциатор, уменьшая концентрацию поступающего в него карбонила железа и увеличивая в нем объемную скорость реакционного газа.
 2015-06-04
2015-06-04 3432
3432







