При химических превращениях происходит изменение внутренней энергии системы, обусловленное тем, что внутренняя энергия продуктов реакции отличается от внутренней энергии исходных веществ.
Изменение внутренней энергии в процессе химического превращения происходит, как и в других случаях, путём поглощения или выделения теплоты и совершения работы. Работа в этом случае обычно мала. Теплота же реакции часто значительна, во многих случаях она может быть непосредственно измерена. Изучением теплот химических реакций занимается термохимия.
Изменение внутренней энергии при химическом превращении не зависит от пути, по которому протекает реакция, а лишь от химической природы исходных веществ и продуктов реакции.
Теплота реакции в общем не является изменением функции состояния и зависит от пути процесса. Однако по крайней мере в двух простейших случаях независимость от пути распространяется и на теплоты процесса.
Если реакция протекает при постоянных объёме и температуре (T = const и V = const) и при этом не совершается работа 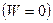 , то согласно уравнению (I,57):
, то согласно уравнению (I,57):
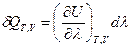 (I, 60), где
(I, 60), где 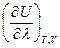 =
= 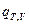
Тогда, разделив обе части уравнения (I, 60) на 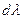 , получим:
, получим: 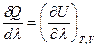
Принимая во внимание, что T = const и V = const, частную производную 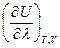 можно заменить на полную производную
можно заменить на полную производную 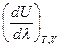 , из чего следует, что
, из чего следует, что
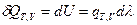
После интегрирования получим: 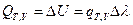 (I, 61)
(I, 61)
Если D 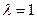 , то
, то 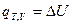
Аналогично, если реакция протекает при постоянных давлении и температуре
(T = const и Р = const), то согласно уравнению (I,59)
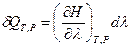 где
где 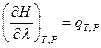
тогда 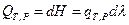 и
и 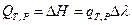 (I, 62)
(I, 62)
Если D 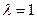 , то
, то 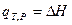
Таким образом, в указанных двух случаях теплота процесса (тепловой эффект реакции) равна изменению функций состояния и по этой причине обладает свойствами этих функций состояния - не зависит от пути процесса, а лишь от начального и конечного состояний. Указанный закон был открыт в 1836 г. русским учёным Г.И.Гессом и носит его имя.
Итак, закон Гесса гласит: если из данных исходных веществ получить заданные конечные продукты разными путями, то суммарная теплота процесса на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, т.е. не зависит от пути перехода от исходных веществ к продуктам реакции.
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (так называемый закон Лавуазье – Лапласа).
2. Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое.
С + О2 ––> СО + 1/2 О2 ΔН1
С + О2 ––> СО2 ΔН2
СО + 1/2 О2 ––> СО2 ΔН3
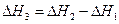 (I, 63)
(I, 63)
3. Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое.
С(алмаз) + О2 ––> СО2 ΔН1
С(графит) + О2 ––> СО2 ΔН2
С(алмаз) ––> С(графит) ΔН3
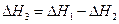 (I, 64)
(I, 64)
4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
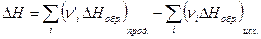 (I, 65)
(I, 65)
Теплотой образования соединения называется тепловой эффект реакции образования одного моля соединения из соответствующих простых веществ, находящихся в той модификации и том агрегатном состоянии, которые устойчивы при данной температуре и давлении 1 атм. Состояние простых веществ, из которых рассматривается образование химического соединения при данных условиях, получило название базисной формы элемента. При 298 К такими формами для углерода является графит, для серы – ромбическая сера, для ртути – жидкая ртуть и т.д.
Значения теплот образования 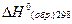 для многих веществ приводятся в справочной литературе. Также эти данные для более 30.000 органических соединений могут быть найдены на сайте www.webbook.nist.gov/chemistry/
для многих веществ приводятся в справочной литературе. Также эти данные для более 30.000 органических соединений могут быть найдены на сайте www.webbook.nist.gov/chemistry/
5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
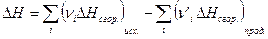 (I, 66)
(I, 66)
Теплотой сгорания соединения называется тепловой эффект реакции взаимодействия 1 моль химического соединения и кислорода с образованием высших стабильных оксидов (Н2О (жидк.), СО2 и т.д.) или других строго выбранных соединений (N2, SO2, HCl, HBr, HI и т.д.).
Величины тепловых эффектов химических реакций зависят от условий, в которых проводятся реакции. Поэтому табличные значения теплот различных процессов принято относить к стандартному состоянию.
Стандартное состояние характеризуется стандартными условиями: давлением Р0 и составом (мольная доля x0). Комиссия Международного союза по чистой и прикладной химии (IUPAC) определила в качестве основного стандартного состояния для всех газообразных веществ чистое вещество (х0 = 1) в состоянии идеального газа с давлением Р0 = 1 атм. (1,01325 · 105 Па или 760 мм рт. ст.) при любой фиксированной температуре. Для твердых и жидких веществ основное стандартное состояние - это состояние чистого вещества (х0 = 1), находящегося под внешним давлением Р 0 = 1 атм. В определение стандартного состояния IUPAC Т0 не входит, хотя часто говорят о стандартной температуре, равной 298,15 К.
Величины тепловых эффектов реакций при данных условиях называют стандартными тепловыми эффектами – ΔН°298, ΔU°298.
Расчёт тепловых эффектов по энергиям связей. Понятие химической связипозволяет лучше ощутить природу химической реакции: разрыв и образование связей между атомами играет существенную роль в химической реакции. Теплоты, выделяемые или поглощаемые в химических реакциях, можно вычислить путём сложения теплот, поглощаемых при разрыве связей, и теплот, выделяющихся при образовании новых связей. Теплота, или энтальпия, необходимая для разрыва связи, называется энергией связи.
Например, реакцию 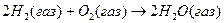 можно записать, обозначив связи в явном виде:
можно записать, обозначив связи в явном виде:
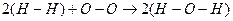
Такая запись показывает, что реакция сопровождается разрывом двух связей водород-водород и одной связи кислород-кислород и образованием четырёх связей кислород-водород. Если энергию связи обозначить eН-Н и ввести аналогичные обозначения для других связей, то тепловой эффект реакции можно представить в следующем виде:
ΔН = 2eН-Н + eО-О - 4eО-Н
Для большинства реакций, пользуясь сравнительно небольшими таблицами энергии связей, можно оценить теплоты многих химических реакций.
Значения энергии связей получают как средние величины, вычисленные из опытных термохимических данных. Также следует учесть, что теплоты реакций в этом случае находят для веществ в газообразном состоянии, поэтому при вычислениях учитываются теплоты испарения и сублимации веществ, находящихся в конденсированном состоянии. Таким образом, в общем случае уравнение для расчёта теплоты реакции может быть записано в следующем виде:
ΔН =(Sniei + ΔНсубл.)исх. – (S  ei)прод.
ei)прод.
 2015-06-04
2015-06-04 1812
1812
