Уравнение первого закона термодинамики для процессов, где совершается только работа расширения, приобретает вид:
δQ = dU + PdV (I, 48)
Если процесс идет при постоянном давлении, то, интегрируя, получаем:
QP = U2 – U1 + P(V2 – V1) (I, 49)
или
QP = (U2 + PV2) – (U1 + PV1) (I, 50)
Так как P и V – параметры состояния, a U – функция состояния, то сумма U + PV такжеявляется функцией состояния и ее изменение в процессе не зависит от пути процесса, а лишь от начального и конечного состояний. Эта функция называется энтальпией и обозначается символом H. Определением величины H служит тождество:
H 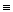 U + PV (I, 51)
U + PV (I, 51)
Энтальпия – это экстенсивное свойство системы, имеющее размерность энергии. Иногда энтальпию называют полной энергией системы при постоянном давлении, т.к. она включает в себя внутреннюю энергию U и энергию, определяемую произведением PV. Абсолютное значение энтальпии не может быть вычислено с помощью уравнений термодинамики, т.к. оно включает в себя абсолютную величину внутренней энергии.
Из уравнения (I, 50) следует, что теплота, поглощаемая при постоянном давлении, равна приросту энтальпии D H и не зависит от пути процесса:
|
|
|
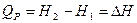 (I,52)
(I,52)
Если принять во внимание, что в соответствии с (I, 7) теплота процесса при постоянном объёме (V=const) определяется следующим выражением
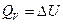 , то легко можно найти связь между QP и QV:
, то легко можно найти связь между QP и QV:
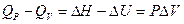 (I, 53)
(I, 53)
 2015-06-04
2015-06-04 1663
1663
