Оценка качества ампулированных препаратов для инъекций проводится по следующим основным показателям:
1. Герметичность
1.1. Горячие ампулы погружают в ванну с водным раствором метиленового синего комнатной температуры. Они быстро охлаждаются, внутри конденсируется пар и образуется разряжение. Если в ампулах имеются трещины, внутрь засасывается краситель и их легко отбраковывать.
1.2. Ампулы, заполненные масляным раствором, после стерилизации опускают в мыльный раствор. При охлаждении в ампуле создается некоторое разряжение, и мыльный раствор проникает в плохо запаянные ампулы. При встряхивании внутри ампулы образуется эмульсия и их легко отбраковывать.
1.3. Ампулы помещают в камеру, герметично закрывают и создают разряжение. При этом из негерметично запаянной ампулы раствор вытекает.
2. Стерильность
2.1. Стерильность каждой серии препарата определяется микробиологическим методом, т.е. посевом на питательную среду. Число образцов должно быть в пределах 3-40 штук. Раствор высевают на.2-е среды: тиогликолевую и Сабуро, ингибируют 14 суток при соответствующих температурах, просматривая ежедневно. При обнаружении роста микроорганизмов хотя бы в одной пробирке испытания повторяют на том же количестве ампул. И только при отсутствии роста при повторном посеве партия считается стерильной. Стерильность серии - это стерильность загрузки одного автоклава. Продукция находится в цехе пока, не будут получены результаты анализа.
2.2. Метод мембранного фильтрования при определении стерильности рекомендован при выраженном антимикробном действии лекарственного вещества и испытании растворов в больших объемах (более 100 мл). Отбирают 30 ампул, делят на 3 группы по 10 штук, 20 используют для испытания на стерильность IO - для контроля полноты отмывания мембраны от лекарственного вещества. Для фильтрования применяют установку с мембраной диаметром 47 мм и размером пор 0,45 ± 0,02 мкм.
Фильтры стерилизуют при температуре 121±1оС 20 мин. Если испытывают порошок, его растворяют в воде для инъекции, фильтруют через стерильную мембрану, которую промывают от раcтвopa 3-5 порциями растворителя по 100 мл, разрезают стерильными ножницами на 2 части, одну из них помещают в колбу с тиогликолевой средой, вторую – в среду Сабуро, 7 дней инкубируют при ежедневном просмотре. Все операции проводят в асептических условиях. При отсутствии роста на двух cpeдaх делают заключение о стерильности серии.
Вымытые ампулы вытирают мягкими полотенцами и направляют на бракераж. Бракераж проводят визуально в темной комнате с помощью щелевидного рефлектора, дающего луч от электролампы мощностью 40 -60 Вт. Каждую ампулу просматривают в этом луче света на темном фоне. Ампулу несколько раз переворачивают; при этом в проходящем свете становятся заметны механические загрязнения. Осмотренные ампулы сразу помещают в лотки от этикетировочной машинки.
Визуальный осмотр ампул очень трудоемок, субъективен и зависит от многих факторов: остроты зрения контролера, времени осмотра, освещенности фона, яркостного контраста между объектом и фоном, количества одновременно осматриваемых ампул. Помимо того, пропуск механических включений возможен в связи с наличием в ампуле, зон невидимости, обусловленных её цилиндрической формой, а также за счет притупления внимания и общей усталости контролеров при монотонных смотровых операциях.
В нашей стране прошли промыленные испытания установки для объективного контроля инъекционных растворов в ампулах (рис. 30).Чувствительным элементом является передающая трубка телевизионной камеры на базе установки ПТУ-29. Оптическая часть представлена двумя осветителями, приспособлением для расширения зоны просмотра и диафрагменной системой. Ампула с раствором раскручивается с большой скоростью, чтобы создать воронку жидкости, доходящую де дна сосуда, затем скорость уменьшается, но раствор продолжает вращаться в ампуле по инерции. Частицы переходят во взвешенное состояние, а пузырьки воздуха разрушаются. Световой поток от осветителей проходит раствор, а присутствующие частицы его рассеивают. Это улавливается объективом передающей телевизионной камеры. Сигнал поступает на блок обработки информации, где фиксируется наличие механических частиц (минимальный размер – 5мкм) и объём наполнения ампулы. Время наблюдения может быть от 1 до 3.5 с. Результат работы установки выше в 4 раза производительности 5 контролёров.
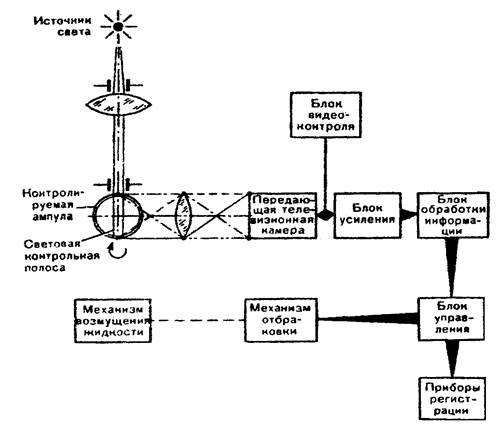
Рис.30. Устройство установки для объективного контроля чистоты раствора в ампулах (Л.А. Иванова, 1991)
4. Пирогенность
В связи с опасностью пирогенного эффекта, проверке на пирогенность подвергаются вода для инъекций и растворы, вводимые внутривенно в объёмах 10мл и более. Обязательно должны проверяться 5% раствор глюкозы, изотонический раствор натрия хлорида и раствор желатина. Испытание на пирогенность можно проводить следующими методами:
4.1.Бииологическим:
4.1.1. Рекомендованным ГФ ХI издания (т. 1, с. 183-185);
4.1.2. ЛАЛ – тестом;
4.2. Микробиологическим;
4.3. Химическим (методом, разработанным ВНИИФ);
4.4.Физико-химическим:
4.4.1. Полярографией;
4.4.2. Спектрофотомерией;
4.4.3. Люминесцентным методом.
Биологический фармакопейный метод испытания на пирогенность является стандартным и обязателен для выполнения. На ЛАЛ-тест составлен проект фармакопейной статьи. Остальные методы находятся на стадии разработки.
4.1.1. Биологический фармакопейный метод
Испытание проводят на здоровых кроликах обоего пола, не альбиносах, массой 2-3,5 кг, содержащихся на полноценном рационе. Каждый кролик должен находиться в отдельной клетке в помещении с постоянной температурой. Колебания температуры не могут превышать ±3%. При уборке клеток, взвешивании животных их оберегают от возбуждения (избегать шума и резких движений). В течение недели, предшествующей опыту, кролики не должны терять в массе. Животные, теряющие в массе, к опыту не пригодны. В течение 3 суток перед испытанием у каждого подопытого кролика измеряют температуру. Исходная температура подопытных кроликов должна быть в пределах 38,5-39,5оС. Животные с более высокой или более низкой температурой для опыта не пригодны. Кроме того, кроликов, впервые предназначаемых для испытания, проверяют на реактивность путем внутривенного введения 10 мл/кг 0,9% стерильного непирогенного раствора натрия хлорида, соответствующего требованиям фармакопейной статьи. В случае изменения температуры у кроликов более чем на ±0,4 оС животные считаются непригодными для опыта. Не позднее, чем, за 16 ч до опыта кроликов переводят в помещение, в котором осуществляют испытание на пирогенность.
Оно должно проводиться в отдельной комнате с постоянной температурой, не отличающейся от температуры помещения, в котором кролики постоянно содержались до опыта, более нем на ±20С, и с колебаниями во время испытания, не превышающими 20С, изолированной от шума, в спокойной обстановке. Вечером накануне опыта у животных отбирают остаток корма. До и вовремя опыта животные корма не получают (воду дают без ограничения).
Если нет других указании в частной статье, для испытания отбирают не менее 2 флаконов или ампул от каждой серии, содержащей от 1000 до 10000 флаконов или ампул. При количестве в серии флаконов или ампул более 10000 отбирают по 3 флакона или ампулы от каждой серии. Из отобранных флаконов или ампул готовят общий раствор (смешанная проба). От серии, содержащей до 1000 флаконов или ампул, отбирают по 1 флакону или ампуле. Испытуемые инъекционные растворы должны быть стерильны. Их подогревают до 37оС и вводят кроликам в ушную вену в количествах, предусмотренных соответствующими частными статьями, в течение 2 минут.
Испытуемый раствор проверяют на 3 кроликах. Группа должна состоять из животных, близких по массе (отличающихся не более, чем на 0,5 кг). Перед введением раствора у кролика с интервалом 30 минут измеряют температуру. Различия в показателях температуры не должны превышать 0,2 оС. В противном случае кролик для испытания не используется. Результат последнего измерения принимают за исходную температуру. Раствор вводят не позднее, чем через 15-30 минут после последнего измерения температуры. Последующее измерение температуры проводят 3 раза с промежутками в один час. Раствор считают непирогенным, если сумма повышений температуры у 3-х кроликов меньше или равна 1,4 оС. Если эта сумма превышает 2,2оС, то раствор считают пирогенным. В случае, когда сумма повышений температуры у 3-х кроликов находится в пределах от 1,5 до 2,2оС, испытание повторяют дополнительно на 5 кроликах. В этом случае раствор считают непирогенным, если сумма повышения температуры у всех 8 кроликов не превышает 3,7оС. Если же эта сумма равна 3,8оС или больше, раствор считают пирогенным.
Несмотря на специфичность, данный метод имеет ряд недостатков:
а) необходимость содержания животных и yxoд за ними;
б) невозможность повторного, использования кроликов для определения пирогенность в последующих объектах;
в) широкий диапазон биологических функциональных колебаний и ответной реакции кроликов на одну и туже дозу пирогена;
г) невозможность определения дозы пирогена в исследуемом препарате, лекарственной форме;
д) возможность несоответствия величины пирогенных доз для кролика и человека. Описаны случаи апирогенности раствора для кролика и пирогенной реакции у человека.
4.1.2. Существует еще один биологический метод определения пирогенности инъекционных растворов, так называемый ЛАЛ-тест. Впервые он был предложен фармакопеей США и носил название Limulus - тест". В его основе лежит процесс физико-химического взаимодействия эндотоксинов с лизатом клеток (амебоцитов) крови мечехвостов, в результате, которого происходит образование геля различной плотности. Поскольку первые исследования проводились на мечехвостах Limulus polyphemus реактив, пригoтoвленный из их крови, был назван "Лизат Амебоцитов ЛИМУЛЮС", или сокращенно ЛАЛ-реактив, а метод, в котором он используется, получил название ЛАЛ-теста.
Для проведения ЛАЛ-теста необходимы:
а) ЛАЛ-реактив;
б) Рабочий стандартный образец (РСО) эндотоксина, т.е. препарат эндотоксина, оттитрованный фирмой-производителем по Американскому национальному стандарту эндотоксина RSE (ЕС-5). Содержание эндотоксина выражается в единицах эндотоксина (ЕДЭ).
Эндотоксин, включенный в набор для анализа по ЛАЛ-тесту, может быть в виде раствора или сублимационно высушенного вещества. В последнем случае его разводят водой для ЛАЛ-теста в соответствии с указаниями фирмы-производителя.
При хранении не допускается замораживание раствора эндотоксина. Рабочие разведения эндотоксина хранению не подлежат, за исключением тех случаев, когда способ хранения описан фирмой-производителем.
в) Вода для ЛАЛ-теста должна быть свободна от бактериальных эндотоксинов. Такого качества вода (содержание эндотоксинов ≤ 0,001 ЕД/мл) обычно входит в состав наборов для анализа по ЛAЛ-тecту.
Следует помнить, что рН раствора испытyемогo препарата должна находится в пределах 6,7-7,5. Для коррекции этого показателя в раствор препарата следует добавлять стерильные, свободные от эндотоксинов растворы NaOH, НСI или подходящий буфер.
Качественный ЛАЛ-тест проводится следующим образом: содержимое ампулы или флакона разводят водой. Кратность предельного максимального разведения (К) определяют по формуле:
К=А/λ,
где: А - максимально допустимое содержание эндотоксина в препарате, указанное в частной фармакопейной статье;
λ - чувствительность ЛАЛ-реактива, указанная фирмой производителем на этикетке упаковки.
Определение проводят в 2-х параллельных пробах. Полученный раствор препарата по 0,1 мл помещают в две стеклянные пробирки диаметром 10 мм и добавляют по 0,1 мл ЛАЛ-реактива. В 2-х других пробирках проводят контроль ингибирования испытуемым препаратом реакции эндотоксина с ЛАЛ-реактивом. Для этого к раствору испытуемого препарата добавляют стaндaртный эндотоксин в концентрации вдвое превышающей чувствительность ЛАЛ-реактива.
Одновременно ставят положительный и отрицательный контроль опыта. Для проведения положительного контроля в две пробирки помещают по 0,1 мл ЛАЛ-реактива и по 0,l мл раствора РСО эндотоксина в концентрации в два раза превышающей чувствительность ЛАЛ-теста. Для проведения отрицательного контроля в 2 пробирки помещают по 0,1 мл ЛАЛ-реактива и по 0,1 мл воды для ЛАЛ-теста.
Все реакционные смеси аккуратно перемешивают и одновременно помещают на 60 минут в водяную баню или термостат с температурой 37± 1°С. По истечении указанного срока результаты регистрируются только как положительные или отрицательные. Положительная реакции характеризуется образованием плотного геля, который не разрушается при перевороте пробирки на 180°. При отрицательной реакции такой гель не образуется.
Результаты испытания лекарственного препарата с помощью ЛАЛ-теста можно оценивать лишь в том случае, когда в обеих пробирках с отрицательным контролем реакция отрицательна, а в обеих с положительным контролем - положительна.
Если в контpoле ингибирования испытуемым препаратом взаимодействия эндотоксина с ЛАЛ-реактивом реакция отрицательна, это означает, что данный препарат способен препятствовать указанной реакции. В этом случае результаты ЛАЛ-теста признаются недействительными.
Препарат считают выдержавшим испытания, если реакция отрицательна в обеих параллельных пробах. Если реакция положительна хотя бы в одной из проб, испытание повторяют с помощью полуколичественного теста, суть которого приводится ниже.
Испытуемый препарат проверяют в ряду последовательных двукратных разведений водой для ЛАЛ-теста. Условия проведения полуколичественного tecta такие же, как и для качественного теста. Определение проводят в 2-х повторностях. Контроль ингибирования испытуемым препаратом реакции эндотоксина с ЛАЛ-реактивом готовят для каждого разведения и также повторяют дважды. Отрицательный и положительный контроли ставят для всех серий разведений. Bce про6ирки инкубируются одновременно.
Для расчета количества эндотоксина в испытуемом препарате отмечается наиболее высокое разведение, дающее плотный гель, хотя бы в одной повторности. Содержание бактериальных эндотоксинов (С) определяется по формуле:
С=Т· λ,
где: Т-титр наиболее высокого разведения препарата, дающего плотный гель;
λ - чувствительность ЛАЛ-реактива, указанная фирмой производителем на этикетке упаковки.
Препарат считается выдержавшим испытания, если полученное при определении количественное содержание эндотоксина в нем не превышает максимально допустимую величину, указанную в частной фармакопейной статье.
4.2. Микробиологическим, суть которого заключается в следующем: определенный объем инъекционного раствора до стерилизации фильтруют через мембранный фильтр, который затем подращивают на поверхности питательного агара 18-20 часов. Затем ведут подсчет выросших колоний и определяют их принадлежность к грамположительной и грамотрицательной флоре. При количестве 103-104 микроорганизмов в 1 мл пирогенность присуща всем видам бактерий.
4.3. Во ВНИИФ разработан более простой, чувствительный метод, основанный на способнocти грамотрицательных микроорганизмов (основных продуцентов пирогенных веществ) образовывать гель в 3% растворе калия гидроксида.
4.4. Проводят также исследования по разработке физико-химических методов анализа пирогенных веществ, преимуществом которых является большая чувствительность, простота, доступность, сокращение экономических затрат и времени исследований (полярография; люминесцентный метод, спектрофотомерия).
 2015-06-04
2015-06-04 2679
2679








