Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. В этой модели предполагается следующее: молекулы газа обладают пренебрежимо малыми размера по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударении друг с другом и стенками сосуда действуют силы отталкивания. Качественное объяснение явления давления газа заключается в том, что молекулы идеального газа при столкновениях со стенками сосуда взаимодействуют с ними как упругие тела. При столкновении молекулы со стенкой сосуда проекция вектора скорости на ось, перпендикулярную стенке, меняется на противоположную. Поэтому при столкновении проекция скорости меняется от –mvx до mvx, и изменение импульса равно 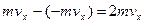 . Во время столкновения молекула действует на стенку с силой, равной по третьему закону Ньютона силе, противоположной по направлению. Молекул очень много, и среднее значение геометрической суммы сил, действующих со стороны отдельных молекул, и образует силу давления газа на стенки сосуда. Давление газа равно отношению модуля силы давления к площади стенки сосуда: p=F/S. Предположим, что газ находится в кубическом сосуде. Импульс одной молекулы составляет 2 mv, одна молекула воздействует на стенку в среднем с силой 2mv/Dt. Время Dt движения от одной стенки сосуда к другой равно 2l/v, следовательно,
. Во время столкновения молекула действует на стенку с силой, равной по третьему закону Ньютона силе, противоположной по направлению. Молекул очень много, и среднее значение геометрической суммы сил, действующих со стороны отдельных молекул, и образует силу давления газа на стенки сосуда. Давление газа равно отношению модуля силы давления к площади стенки сосуда: p=F/S. Предположим, что газ находится в кубическом сосуде. Импульс одной молекулы составляет 2 mv, одна молекула воздействует на стенку в среднем с силой 2mv/Dt. Время Dt движения от одной стенки сосуда к другой равно 2l/v, следовательно, 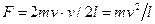 . Сила давления на стенку сосуда всех молекул пропорциональна их числу, т.е.
. Сила давления на стенку сосуда всех молекул пропорциональна их числу, т.е. 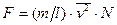 . Из-за полной хаотичности движения молекул движение их по каждому из направлений равновероятно и равно 1/3 от общего числа молекул. Таким образом,
. Из-за полной хаотичности движения молекул движение их по каждому из направлений равновероятно и равно 1/3 от общего числа молекул. Таким образом, 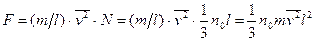 . Так как давление производится на грань куба площадью l2, то давление будет равно
. Так как давление производится на грань куба площадью l2, то давление будет равно 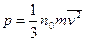 . Это уравнение называется основным уравнением молекулярно-кинетической теории. Обозначив за
. Это уравнение называется основным уравнением молекулярно-кинетической теории. Обозначив за 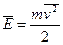 среднюю кинетическую энергию молекул, получим
среднюю кинетическую энергию молекул, получим 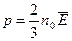 .
.
Масса и размер молекул. Постоянная Авогадро:
Любое вещество состоит из частиц, поэтому количество вещества принято считать пропорциональным числу частиц. Единицей количества вещества является моль. Моль равен количеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода.
Отношение числа молекул к количеству вещества называется постоянной Авогадро:
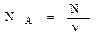
Постоянная Авогадро равна 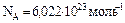 . Она показывает, сколько атомов или молекул содержится в одном моле вещества.
. Она показывает, сколько атомов или молекул содержится в одном моле вещества.
Количество вещества можно найти как отношение числа атомов или молекул вещества к постоянной Авогадро:
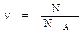
Молярной массой называется величина, равная отношению массы вещества к количеству вещества:
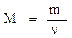
Молярную массу можно выразить через массу молекулы:
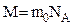
Для определения массы молекул нужно разделить массу вещества на число молекул в нем:
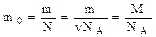
 2015-06-05
2015-06-05 637
637








