Задача. Сухой воздух имеет состав 78,09% N2, 20,95% О2, 0,93% Ar и 0,03% СО2.
Определить массу сухого воздуха в комнате объемом V = 40 м3
при t = 22оC и нормальном давлении Ро = 101,325 кПа.
Решение: уравнение для смеси газов 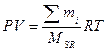 ,
, 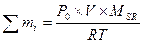
Msr = ∑δi×Mi = 0,7809×28 + 0,2095×32 + 0,0003×44 = 29
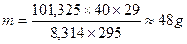 Ответ: 48 г.
Ответ: 48 г.
Задача. В баллоне объемом 2000 м3 смешали 1кг N2, 2 кг О2 и 3 кг Н2.
Вычислить парциальные объемы газов и парциальные давления газов
в баллоне при 17оС. TоK = 273 + 17 = 290оC.
Решение: парциальное давление газа в баллоне 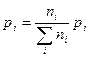
парциальный мольный объём газа 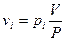
давление газов в баллоне P = (∑ni ×RT)/V
Число молей газа в баллоне:N = ∑ni = 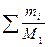 =
=
1000/28,02 + 2000/32 + 3000/2 = 35,71 + 62,5 + 1500 = 1598,21
Давление газов в баллоне
Р = [1598,21×8,314×290]/(2000×1000) л = 1,927кПа.
Парциальное давление газа:
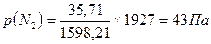 , р(О2) =75Па, р(Н2) = 1809Па
, р(О2) =75Па, р(Н2) = 1809Па
Парциальный мольный объем газа:
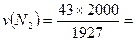 44,6 м3, v(O2)=77,84 м3, v(H2) = 1877,53 м3
44,6 м3, v(O2)=77,84 м3, v(H2) = 1877,53 м3
Задача. Вычислить, ск. литров воздуха потребуется для сжигания 10 кг угля,
содержащего 1% примеси. Кислорода в воздухе 20%.
Решение: С + О2 = СО2. Масса углерода в 10 кг угля 10×0,99 = 9,9кг. При сжигании 1 моля угля (12г) потребуется 1 моль О2(32г); при сжигании 9,9кг угля
(это 9900/12= 825молей) потребуется 825 молей кислорода, или 825/0,2 = 4125
молей воздуха. 1 моль воздуха это 22,4 л., 4125 молей это 92400 л или 92,4 м3.
 2015-06-05
2015-06-05 782
782








