Пример газофазного раствора – воздух. Состав воздуха – 21% кислорода,
78% - азота, 1% - остальные газы. Средняя молярная масса воздуха – 29. Для смеси газов справедлив закон Дальтона: давление газовой смеси равно сумме парциональных давлений всех входящих в неё газов Р = ∑рi. Если объем газовой смеси V, тогда парциальное давление компонента газовой смеси равно давлению этого компонента при условии, что он один занимает весь объем V. Тогда
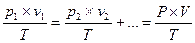 и v1 + v2 + v3 + … = V
и v1 + v2 + v3 + … = V
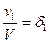 объемная доля газа, входящего в состав смеси газов:
объемная доля газа, входящего в состав смеси газов:
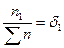 молярная доля газа;
молярная доля газа; 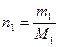 число молей газа 1; М1 = молярная масса газа 1.
число молей газа 1; М1 = молярная масса газа 1.
Газовые уравнения и законы.
Уравнение Клапейрона – Менделеева: 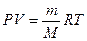 ,
, 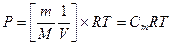 ;
;
Cm – молярная концентрация раствора. P = CmRT
[P] = кПа; [m] – масса газа, граммы; R = 8,314 [Дж/(моль×К], [V] = литр.
Уравнение Клапейрона – Менделеева для смеси газов:
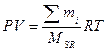 , MSR = M1×δ1+ M2×δ2 + M3×δ3 +..средняя мол. масса смеси газов
, MSR = M1×δ1+ M2×δ2 + M3×δ3 +..средняя мол. масса смеси газов
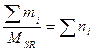 - число молей газа в смеси, P×V = ∑ni ×RT
- число молей газа в смеси, P×V = ∑ni ×RT
[P] = кПа; [m] – масса газа, граммы; R = 8,314 [Дж/(моль×оК], [V] = литр.
Законы Авагардо: 1 моль любого газа содержит 6,022×1023 молекул;
При н.у. [T = 273,15оK, P = 101325 Па = 1,013 бара]
один моль газа занимает объем 22,4 литра.
Плотность газа при н.у. 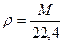 [г/л].
[г/л].
 2015-06-05
2015-06-05 996
996








