1. Адсорбция обусловлена физическими силами (силами Ван-дер-Ваальса). Основной вклад вносят дальнодействующие дисперсионные силы аддитивные и не зависящие от температуры.
2. На поверхности адсорбента нет активных центров (энергетически однородная поверхность).
3. Адсорбционные силы действуют на больших расстояниях, что приводит к образованию полимолекулярного слоя. По мере удаления от поверхности действие адсорбционных сил уменьшается и на некотором расстоянии практически становится равным нулю.
4. Адсорбционные силы не зависят от температуры.
5. Практически все адсорбированное вещество на поверхности адсорбента находится в жидком состоянии.
В теории проводится аналогия между адсорбцией и конденсацией пара. Предполагается, что в результате взаимодействия с поверхностью газ сжимается до давления насыщения рS и переходит в жидкость. При этом возникает адсорбционный объем жидкости V адс, который связан с величиной адсорбции соотношением:
V адс = А·Vm, (3.19)
где А – значение адсорбции в моль; Vm – мольный объем адсорбата в конденсированном состоянии (объем 1 моль жидкого адсорбата).
Адсорбционный объем V адс (толщиной l) может быть представлен посредством ряда эквипотенциальных поверхностей (рис. 3.10), каждая поверхность соответствует определенному значению адсорбционного потенциала ε, который имеет максимальное значение у поверхности и минимальное – на границе адсорбционного слоя.
Адсорбционный потенциал – работа обратимого изотермического процесса по переносу 1 моль адсорбата из данной точки адсорбционного объема в газовую фазу (работа против действия адсорбционных сил).
Работа по переносу молекулы из точки 1 больше, чем из точки 2. следовательно: ε1 > ε2> ε3. Максимальный адсорбционный потенциал наблюдается вблизи поверхности адсорбента.
Рассматривая молекулы адсорбата как идеальный газ, можно записать, что адсорбционный потенциал равен работе расширения или сжатия идеального газа:
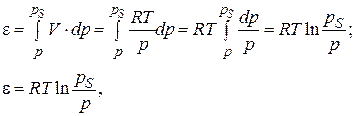 (3.20)
(3.20)
где рS – насыщенное давление газа (пара) при данной температуре (константа для каждого газа); р – равновесное давление в объемной фазе вдали от поверхности.
Зависимость адсорбционного потенциала (ε) от адсорбционного объема (V адс) Поляни назвал характеристической кривой. Характеристическая кривая не зависит от температуры и индивидуальна и характерна для каждого вида адсорбента для сходных адсорбатов.
Характер характеристической кривой, построенной по экспериментальным данным (рис. 3.11), не зависит от температуры.
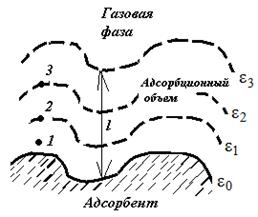 | 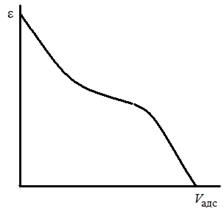 |
| Рис. 3.10. Схематический разрез адсорбционного объема по теории Поляни | Рис. 3.11. Характеристическая кривая |
Теория Поляни имеет большое практическое значение, т.к. позволяет рассчитывать изотермы адсорбции различных адсорбатов на одних и тех же адсорбентах при любой температуре.
Пусть имеется экспериментальная зависимость  для одного адсорбата при температуре Т 1. Необходимо рассчитать и построить изотерму адсорбции для другого адсорбата при температуре Т 2. Для этого:
для одного адсорбата при температуре Т 1. Необходимо рассчитать и построить изотерму адсорбции для другого адсорбата при температуре Т 2. Для этого:
1. Построим характеристическую кривую при температуре Т 1. Для этого рассчитаем значение адсорбционного потенциала по уравнению (3.20) (величина 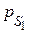 – константа для первого адсорбата) и значение адсорбционного объема по уравнению
– константа для первого адсорбата) и значение адсорбционного объема по уравнению 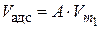 .
.
2. Точки характеристической кривой подставляем в уравнение (3.20) при температуре Т 2 и значении 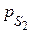 для другого адсорбата, и получаем значения р 2. Также рассчитываем значение адсорбции А по уравнению
для другого адсорбата, и получаем значения р 2. Также рассчитываем значение адсорбции А по уравнению 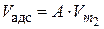 , зная значение
, зная значение 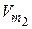 – константа для адсорбата.
– константа для адсорбата.
Адсорбционные потенциалы для разных адсорбатов на одном и том же адсорбенте находятся в постоянном соотношении. Это соотношение называется коэффициентом аффинности (близости, сродства):

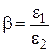 . (3.21)
. (3.21)
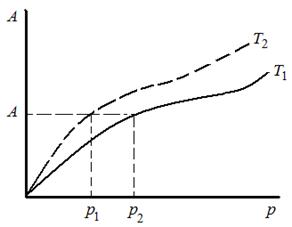 Рис. 3.12. Изотермы адсорбции Поляни при двух температурах Рис. 3.12. Изотермы адсорбции Поляни при двух температурах | Если имеется изотерма адсорбции и известно значение коэффициента аффинности для одного адсорбата, то можно построить изотерму адсорбции для другого адсорбата. Таким образом, теория Поляни, хотя и не дает аналитического выражения для изотермы адсорбции, однако позволяет вычислить адсорбцию для любой заданной температуры, если известна хотя бы одна изотерма при одной температуре и имеется характеристическая кривая конкретного адсорбента. |
Так как по теории Поляни практически все адсорбированное вещество находится на поверхности в жидком состоянии, то эта теория оказалась пригодной для описания адсорбции на пористых адсорбентах, в порах которых происходит конденсация пара.
Адсорбция паров на пористых сорбентах, удельная поверхность которых достигает сотен тысяч квадратных метров, имеет более сложный характер по сравнению с адсорбцией на непористых телах той же химической природы. Как правило, она сопровождается капиллярной конденсацией – конденсацией пара в порах при давлениях меньших, тем давление насыщенного пара адсорбата над плоской поверхностью.
Пример 3.2. При изучении адсорбции сернистого ангидрида SO2 (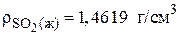 ) на силикагеле при различных температурах были получены следующие экспериментальные данные:
) на силикагеле при различных температурах были получены следующие экспериментальные данные:
T = 303 К
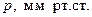 | |||||
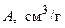 | 33,4 | 47,5 | 52,4 | 56,3 |
T = 313 К
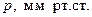 | |||||
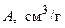 | 38,75 | 44,55 | 48,55 | 51,85 |
1. Постройте изотерму адсорбции сернистого ангидрида при различных температурах, сделайте вывод о зависимости величины адсорбции от температуры.
2. Рассчитайте и постойте характеристическую кривую.
Решение:
1. По экспериментальным данным построим изотермы адсорбции сернистого ангидрида на силикагеле при различных температурах (рис. 3.13). Из графиков видно, что с увеличением температуры адсорбция уменьшается.
2. Для построения характеристической кривой рассчитаем адсорбционный объем и адсорбционный потенциал по уравнениям (3.19) и (3.20):
а) для расчета адсорбционного потенциала воспользуемся табличными значениями давления насыщенного пара (рS) сернистого ангидрида при различных температурах.
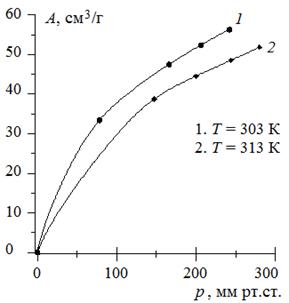
Рис. 3.13. Изотермы адсорбции сернистого ангидрида
на силикагеле при различных температурах
Давление насыщенного пара (рS) сернистого ангидрида
при различных температурах
| Т, К | ||
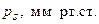 | 349,6 | 471,2 |
Рассчитаем адсорбционный потенциал при Т = 303 К для р = 78 мм рт.ст. по уравнению (3.20):
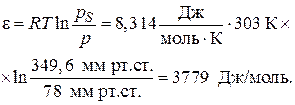
Аналогичный расчет проведем для других давлений при температурах 303 К и 313 К. Полученные результаты занесем в таблицы.
T = 303 К
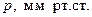 | ||||
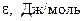 |
T = 313 К
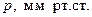 | ||||
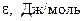 |
б) Для расчета адсорбционного объема (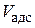 ):
):
Пересчитаем величину адсорбции в размерность моль/г, для этого рассчитаем количество моль SO2, адсорбированного 1 г геля кремневой кислоты:
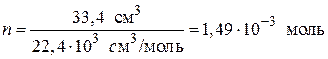 .
.
Рассчитаем мольный объем сернистого ангидрида:
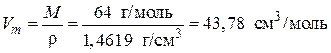 ,
,
где 64 г/моль – молярная масса SO2; 1,4619 г/см3 – плотность жидкого SO2.
Рассчитаем адсорбционный объем при Т = 303 К для А = 33,4 см3/г = =1,49·10–3 моль/гпо уравнению (3.19):
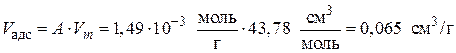 .
.
Аналогичный расчет проведем для других величин адсорбции при температурах 303 К и 313 К. Полученные результаты занесем в таблицы.
T = 303 К
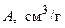 | 33,4 | 47,5 | 52,4 | 56,3 |
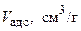 | 0,065 | 0,093 | 0,102 | 0,110 |
T = 313 К
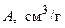 | 38,75 | 44,55 | 48,55 | 51,85 |
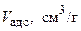 | 0,076 | 0,087 | 0,095 | 0,101 |
в) Занесем результаты расчетов адсорбционного объема и адсорбционного потенциала при двух температурах в таблицы:
T = 303 К
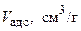 | 0,065 | 0,093 | 0,102 | 0,110 |
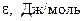 |
T = 313 К
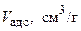 | 0,076 | 0,087 | 0,095 | 0,101 |
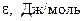 |
г) Строим характеристическую кривую.
Из рис. 3.14 видно, что все рассчитанные при разных температурах точки легли на одну кривую, следовательно, характеристическая кривая действительно не зависит от температуры, индивидуальна и характерна для каждого адсорбента.
Мы рассмотрели кратко две теории адсорбции – теорию мономолекулярной адсорбции Лэнгмюра и теорию полимолекулярной адсорбции Поляни, на первый взгляд исключающие друг друга. Возникает вопрос, какая из этих теорий более правильная? На это следует ответить, что обе теории ограничены в применении. В зависимости от природы адсорбента и адсорбата, от условий сорбции в одних случаях применима одна, а в других – другая теория адсорбции. Теория Поляни применима только к явлениям чисто физической адсорбции. Теория Лэнгмюра охватывает с известными ограничениями явления как физической, так и химической адсорбции. Однако теория Лэнгмюра не может быть применена для объяснения адсорбции на тонкопористых сорбентах, имеющих сужающиеся поры.
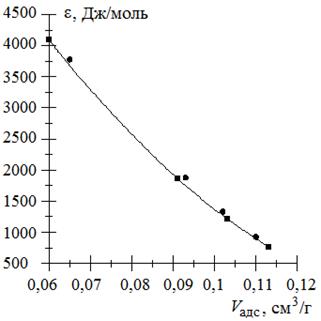
Рис. 3.14. Характеристическая кривая
для силикагеля
В большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию,
и влияние поверхностных сил может распространяться на второй, третий и последующие адсорбционные слои. Эта возможность реализуется, когда пары и газы адсорбируются при температурах ниже критической. В этом случае образуются полимолекулярные слои адсорбата на поверхности адсорбента. Полимолекулярную адсорбцию можно представить как результат вынужденной конденсации пара под действием поверхностных сил.
 2015-06-05
2015-06-05 8111
8111








