1. На поверхности адсорбента имеется определенное число равноценных в энергетическом отношении активных центров (поверхность однородна, все активные центры одинаковой силы).
2. Взаимодействие соседних адсорбированных молекул в первом и последующих слоях отсутствуют.
3. Каждая молекула предыдущего слоя представляет собой возможный активный центр для адсорбции молекулы следующего адсорбционного слоя (адсорбция многослойна).
4. Первый слой адсорбата образуется в результате действия сил Ван-дер-Ваальса между адсорбентом и адсорбатом, последующие в результате конденсации.
5. Все молекулы во втором и более далеких слоях ведут себя подобно молекулам жидкости.
6. Возможно построение последующих слоев при незаполненном первом.
Таким образом, адсорбированная фаза может быть представлена как совокупность адсорбционных комплексов – цепей молекул, первая из которых связана с поверхностью адсорбента. Все эти цепи энергетически не взаимодействуют друг с другом. Схема строения адсорбционного слоя по теории БЭТ показана на рис. 3.16.
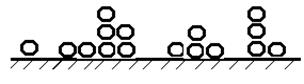
Рис. 3.16. Схема строения адсорбционного слоя
по теории БЭТ
Для вывода уравнения в теории БЭТ приняты следующие допущения:
1. Уравнение Лэнгмюра применимо не только к первому слою, но и к последующим слоям.
2. Поверхность адсорбента однородна (все активные центры одинаковой силы).
3. Теория не учитывает взаимодействие между адсорбированными молекулами адсорбата.
Следовательно, теория БЭТ по методу – теория Лэнгмюра, а по природе – теория Поляни.
Процесс адсорбции можно представить в виде последовательных квазихимических реакций:
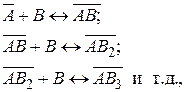
где В – адсорбат; 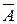 – адсорбционный центр;
– адсорбционный центр; 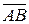 – адсорбционный комплекс.
– адсорбционный комплекс.
С. Брунауэр, П. Эммет и Е. Теллер предложили уравнение полимолекулярной адсорбции БЭТ:
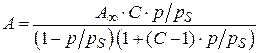 , (3.22)
, (3.22)
где 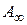 – емкость одного адсорбционного монослоя, зависящая от геометрии молекул и определяемая площадью, которую занимает одна молекула в насыщенном монослое;
– емкость одного адсорбционного монослоя, зависящая от геометрии молекул и определяемая площадью, которую занимает одна молекула в насыщенном монослое; 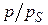 – относительное давление пара (р – равновесное давление пара, рS – давление насыщенного пара); С – константа, характеризующая энергию взаимодействия в адсорбционном слое:
– относительное давление пара (р – равновесное давление пара, рS – давление насыщенного пара); С – константа, характеризующая энергию взаимодействия в адсорбционном слое:
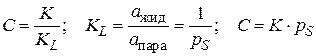 , (3.23)
, (3.23)
где К – константа адсорбционного равновесия в уравнении Лэнгмюра; КL – константа конденсации пара; рS – давление насыщенного пара (константа для каждого вещества).
Для расчета параметров адсорбции по теории БЭТ уравнение полимолекулярной адсорбции приводят к линейному виду. Для этого проводят следующие преобразования:
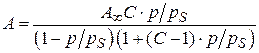 ;
;
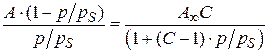 ;
;
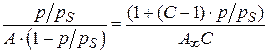 .
.
Получают уравнение полимолекулярной адсорбции БЭТ в линейной форме:
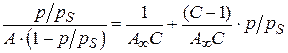 . (3.24)
. (3.24)
Строят изотерму адсорбции в координатах линейной формы уравнения БЭТ (рис. 3.17).
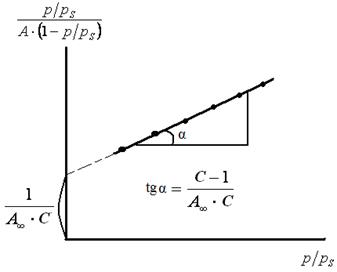
Рис. 3.17. Изотерма адсорбции БЭТ
в линейных координатах
Экстраполяция зависимости до оси ординат дает отрезок, равный:
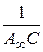 ,
,
тангенс угла наклона прямой равен:
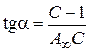 . (3.25)
. (3.25)
Для многих газов и паров полимолекулярная адсорбция имеет существенные отклонения от теории БЭТ. Согласие с теорией тем лучше, чем больше константа адсорбционного равновесия (К). Этому способствует увеличение сродства адсорбата к адсорбенту и уменьшение когезионных сил в конденсате на поверхности. Уравнение изотермы БЭТ хорошо выполняется при относительных давлениях 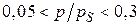 . При р/рS < 0,05 в получаемые результаты вносит искажение неоднородность поверхности, при р/рS > 0,3 – начинает сказываться взаимодействие между адсорбированными молекулами.
. При р/рS < 0,05 в получаемые результаты вносит искажение неоднородность поверхности, при р/рS > 0,3 – начинает сказываться взаимодействие между адсорбированными молекулами.
На тории БЭТ основан стандартный метод измерения удельной поверхности (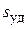 ) адсорбентов, катализаторов, порошков и др. По экспериментальным данным находят величину
) адсорбентов, катализаторов, порошков и др. По экспериментальным данным находят величину 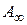 , а затем по уравнению (3.24) рассчитывают удельную поверхность адсорбента:
, а затем по уравнению (3.24) рассчитывают удельную поверхность адсорбента:
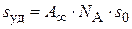 , (3.26)
, (3.26)
где 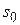 – площадь, занимаемая одной молекулой адсорбата;
– площадь, занимаемая одной молекулой адсорбата; 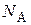 – число Авогадро.
– число Авогадро.
В качестве адсорбатов используют инертные газы (азот, аргон, криптон и др.), которые характеризуются слабым межмолекулярным взаимодействием на поверхности адсорбента (физическая адсорбция), что обеспечивает достоверность результатов. Необходимо, чтобы форма молекулы адсорбата не слишком отличалась от сферической. Для увеличения адсорбции таких газов ее ведут при низких температурах, откуда и частое название метода БЭТ – метод низкотемпературной адсорбции.
В настоящее время предложено много модификаций уравнения теории БЭТ, но они, как правило, описывают только частные случаи изотерм адсорбции. Принципиальные основы теории БЭТ до настоящего времени сохраняют свое значение. В настоящее время теория находит применение в современных работах.
Пример 3.3. Ниже приведены экспериментальные данные адсорбции азота на TiO2 (рутиле) при 75 К.
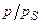 | 0,078 | 0,149 | 0,217 | 0,279 | 0,348 |
| А,моль/кг | 0,367 | 0,417 | 0,467 | 0,512 | 0,567 |
Вычислите константы в уравнении БЭТ, используя которые, рассчитайте удельную поверхность адсорбента, если площадь, занимаемая одной молекулой азота 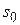 = 0,16 нм2.
= 0,16 нм2.
Решение:
1. Для построения изотермы адсорбции азота в координатах линейной формы уравнения БЭТ (3.24) рассчитаем значения 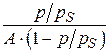 для
для 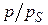 = 0,078:
= 0,078:
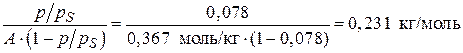 .
.
Аналогично проведем расчет для других значений 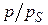 , полученные данные занесем в таблицу.
, полученные данные занесем в таблицу.
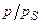 | 0,078 | 0,149 | 0,217 | 0,279 | 0,348 |
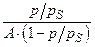 , кг/моль , кг/моль | 0,231 | 0,420 | 0,593 | 0,756 | 0,941 |
2. По рассчитанным данным строим прямую в координатах линейной формы уравнения БЭТ.
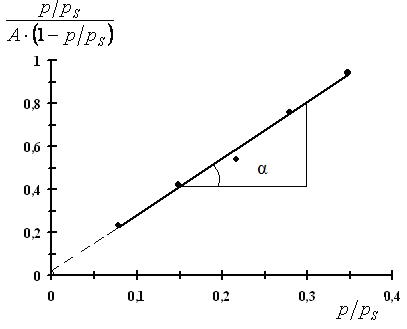
Рис. 3.18. Изотерма адсорбции БЭТ в линейных координатах
3. Из графика находим
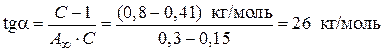 ;
;
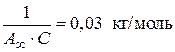 .
.
4. Для нахождения констант в уравнении БЭТ решаем совместно систему уравнений:
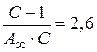 ; (а)
; (а)
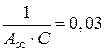 , (б)
, (б)
отсюда
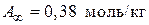 .
.
5. Удельную поверхность адсорбента рассчитываем по уравнению (3.26):
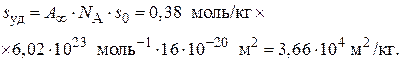
 2015-06-05
2015-06-05 18288
18288
