Явление коагуляции тесно связано с проблемой удаления из водных сред различных загрязнений. В основе многих методов очистки от высокодисперсных седиментационно устойчивых загрязнений лежит явление потери системой агрегативной устойчивости путем объединения частиц под внесением специально вводимых реагентов: коагулянтов и флокулянтов. Это укрупнение частиц приводит к потере седиментационной устойчивости системы и образованию осадков.
В настоящее время подбор реагентов для коагуляции основывается преимущественно на эмпирических исследованиях. Чаще всего коагулирование загрязнений воды производится электролитами, которые содержат многозарядные ионы (Al3+, Fe3+ и др.).
Ранее процесс осветления воды объясняли нейтрализацией многовалентными катионами, заряженных, как правило, отрицательно, частиц природных вод. Однако коагуляция эти ионами связана с процессами их гидролиза, в результате которого возникают полиядерные аквагидрокомплексы, обладающие более сильной коагулирующей способностью, чем ионы. Они образуют также полимерные комплексы, близкие к полиэлектролитам, а сам процесс коагуляции подобен процессу флокуляции высокомолекулярных соединений.
Коагуляцию применяют в очистке сточных вод для ускорения процесса осаждения тонкодисперсных примесей и эмульгированных веществ. Коагуляция наиболее эффективна для удаления из воды коллоидно-дисперсных частиц размером 1–100 мкм. Коагуляция может происходить самопроизвольно или под влиянием физических или химических процессов. В процессе очистки сточных вод коагуляция происходит под влиянием добавляемых к ним специальных веществ – коагулянтов, которые в воде образуют хлопья гидроксидов металлов, частицы которых оседают под действием силы тяжести. Хлопья обладают способность улавливать коллоидные и взвешенные частицы и агрегировать их. Так как коллоидные частицы в воде чаще всего имеют отрицательный заряд, а хлопья коагулянтов положительный заряд, то между ними возникает взаимное притяжение.
Процесс гидролиза коагулянтов и образование хлопьев можно представить следующим образом:
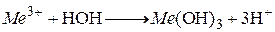
В действительности процесс гидролиза протекает гораздо сложнее. Ион металла образует ряд промежуточных соединений в результате реакций с гидроксид-ионами и полимеризации. Образующиеся соединения имеют положительный заряд и легко адсорбируются отрицательно заряженными коллоидными частицами.
В качестве коагулянтов обычно используют соли алюминия, железа и их смеси. Выбор коагулянта зависит от его состава, физико-химических свойств и стоимости, концентрации примесей в воде, от рН и солевого состава воды.
В качестве коагулянтов используют 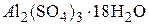 , NaAlO2,
, NaAlO2, 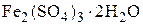 , FeCl3 и др. Совместное применение этих солей дает возможность повысить эффект осветления, увеличить плотность и скорость осаждения хлопьев.
, FeCl3 и др. Совместное применение этих солей дает возможность повысить эффект осветления, увеличить плотность и скорость осаждения хлопьев.
Соли железа как коагулянты имеют ряд преимуществ перед солями алюминия: более широкая область оптимальных значений рН, большая крупность образующихся хлопьев, способность устранять запахи
и привкусы и др. При использовании смесей Al2(SO4)3 и FeCl3 в соотношении 1:1 или 1:2 достигается лучший результат коагулирования, чем при различном использовании реагентов, наблюдается синергизм электролитов.
В процессах водоочистки постепенно расширяется применение полимерных флокулянтов (ВМС): длинная молекула полимера адсорбируется двумя концами на двух разных частицах дисперсной фазы и соединяет их «мостиком». Получается рыхлый агрегат – флокула, в которой частицы не имеют непосредственного контакта между собой. В зависимости от количества вводимого флокулянта, он может обеспечивать как седиментационную неустойчивость в системе, так и ее стабилизацию.
Флокулянты бывают природными и синтетическими, неионогенными и ионогенными. В последнем случае флокуляция возможна не только по механизму мостикообразования, но и путем нейтрализации заряда частиц противоположно заряженными ионами полиэлектролита.
На практике часто эффективным оказывается совместное применение коагулянтов и флокулянтов.
Флокуляция – процесс агрегации взвешенных частиц при добавлении в сточную воду высокомолекулярных соединений, называемых флокулянтами. В отличие от коагуляции при флокуляции агрегация частиц происходит не только при непосредственном контакте частиц, но и в результате взаимодействия молекул адсорбированного на частицах флокулянта. Использование флокулянтов позволяет снизить дозы коагулянтов, уменьшить продолжительность процесса коагуляции и повысить скорость осаждения образующихся хлопьев.
Для очистки сточных вод используют природные (крахмал, декстрин, эфиры, целлюлозы и т.д.) и синтетические (полиакриламид) коагулянты.
Механизм действия флокулянтов основан на следующих явлениях: адсорбции молекул флокулянта на поверхности коллоидных частиц, ретикуляции (образовании сетчатой структуры) молекул флокулянта, слипание коллоидных частиц под действие сил Ван-дер-Ваальса. При действии флокулянтов между коллоидными частицами образуются трехмерные структуры, способные к более быстрому и полному отделению от жидкой фазы. Причиной возникновения таких структур является адсорбция макромолекул флокулянта на нескольких частицах с образованием между ними полимерных мостиков. Коллоидные частицы чаще заряжены отрицательно, что способствует процессу взаимной коагуляции с гидроксидом алюминия или железа.
Поскольку гидроксиды и сульфиды тяжелых металлов (цинка, меди, никеля, свинца, кадмия, кобальта и др.) в сточной воде образуют устойчивые коллоидные системы, то для интенсификации процесса их осаждения необходимо вводить коагулянты и флокулянты. Коллоидные частицы сульфидов имеют отрицательный заряд, поэтому для коагуляции сульфидов используют электролиты с многозарядными катионами – сульфаты алюминия или трехвалентного железа. При коагуляции гилроксидов требуется электролит с многозарядным анионом, т.к. коллоидные частицы заряжены положительно. Хорошими коагулянтами гидроксидов являются сульфат-ионы. Помимо электролитной коагуляции на практике часто используют взаимную коагуляцию коллоидных растворов с противоположным зарядом частиц. Для ускорения процесса коагуляции используют флокулянты, в основном полиакриламид. Добавка его в количестве 0,01 % от массы сухого вещества увеличивает скорость выпадения осадков гидроксидов металлов в 2-3 раза.
Вопросы и задания для самоконтроля
1. Почему термодинамические неустойчивые лиофобные дисперсные системы проявляют некоторую устойчивость?
2. Какие виды устойчивости Вы знаете?
3. Перечислите факторы агрегативной устойчивости.
4. Что такое коагуляция? Перечислите основные причины коагуляции лиофобных золей.
5. От чего зависит скорость коагуляции лиофобных золей? перечислите основные положения теории быстрой коагуляции.
6. Перечислите правила электролитной коагуляции. Что такое порог коагуляции?
7. Охарактеризуйте теории устойчивости лиофобных золей ДЛФО. Что такое расклинивающее давление?
8. Перечислите закономерности коагуляции лиофобных золей электролитами.
9. Какие особые явления при коагуляции Вы знаете?
Глава 6
СТРУКТУРНО-МЕХАНИЧЕСКИЕ
СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
Структурообразование является одним из вариантов коагуляции, которая протекает в дисперсных системах при больших концентрациях дисперсной фазы. При этом система приобретает комплекс новых свойств – структурно-механических (реологических), характеризующих сопротивление деформации (рис. 6.1).
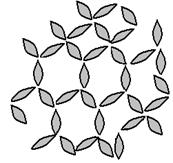
Рис. 6.1. Структурообразование
К структурно-механическим свойствам дисперсных систем относятся закономерности структурообразования в дисперсных системах, а также совокупность механических и реологических свойств, таких как вязкость, упругость, пластичность и т.д.
 2015-06-05
2015-06-05 1610
1610
