Окраска дисперсных систем определяется явлениями рассеяния и поглощения света. Это относится особенно к системам, содержащим токопроводящие частицы (золям металлов). В зависимости от дисперсности золя его окраска может меняться. Например: высокодисперсный золь золота с радиусом частиц дисперсной фазы 20 нм (r = 20 нм) поглощает преимущественно зеленую часть спектра и имеет красную окраску; при увеличении размеров частиц до 50 нм золь золота приобретает синюю окраску. Зеленые растения поглощают красные лучи, т.к. они меньше рассеиваются атмосферой Земли, и приобретают окраску дополнительную к красной.
С явлениями избирательного поглощения и рассеяния света связана окраска драгоценных камней и самоцветов, содержащих высокодисперсные металлические включения: рубин – коллоидный раствор Cr или Au в Al2O3, синий цвет сапфиров обусловлен присутствием Ti в Al2O3, аметист – дисперсия Mn в SiO2.
Законы рассеяния и поглощения света дисперсными системами лежат в основе производства красителей, искусственных минералов.
Вопросы и задания для самоконтроля
1. Какие оптические свойства дисперсных систем вы знаете?
2. В каком случае происходит рассеяние света?
3. Каким уравнением количественно описывается рассеяние света?
4. От чего зависит интенсивность светорассеяния?
5. Какое уравнение количественно описывает поглощение света? Что такое оптическая плотность?
6. Чем определяется окраска дисперсных систем?
Глава 8
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ
СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
К молекулярно-кинетическим дисперсных систем, связанным с тепловым движением частиц относятся: осмос, диффузия, броуновское движение, седиментационное равновесие. Эти свойства присущи для всех систем, содержащих достаточно малые частицы, способные принимать участие в тепловом движении. У дисперсных систем данные свойства характерны только для высокодисперсных систем.
Осмос
Осмос – процесс самопроизвольного перехода молекул растворителя через полупроницаемую мембрану (односторонняя диффузия дисперсионной среды). Давление, которое нужно приложить к системе, чтобы прекратился осмос – осмотическое давление (π).
Величина осмотического давления для разбавленных растворов
неэлектролитов определяется уравнением Вант-Гоффа:
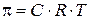 , (8.1)
, (8.1)
где С – концентрация растворенного вещества, моль/л.
В дисперсных системах вместо молярной концентрации вводят понятие частичной концентрации 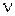 – число кинетических единиц (коллоидных частиц) в единице объема системы (1 л). Частичная концентрация частиц связана с молярной соотношением:
– число кинетических единиц (коллоидных частиц) в единице объема системы (1 л). Частичная концентрация частиц связана с молярной соотношением: 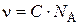 , тогда выражение для расчета осмотического давления в коллоидных растворах примет вид:
, тогда выражение для расчета осмотического давления в коллоидных растворах примет вид:
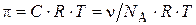 , (8.2)
, (8.2)
где 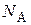 – число Авогадро.
– число Авогадро.
Таким образом, осмотическое давление пропорционально числу частиц, принимающих участие в тепловом движении. Так как размер коллоидных частиц много больше размеров молекул или ионов в истинных растворах при равных массовых концентрациях, величина осмотического давления в коллоидном растворе будет много меньше величины осмотического давления в истинном растворе. Например,
в 1% -м растворе сахара (М = 342 г/моль), представляющем из себя истинный раствор, осмотическое давление составляет 743 мм водяного столба. А в 1%-м растворе желатина (М = 2000 г/моль), образующем коллоидную систему, осмотическое давление всего 10 мм водяного столба.
 2015-06-05
2015-06-05 2536
2536








