Решение данного задания рассмотрим на примере 2-х комплексных соединений: Na[Co(SCN)4(H2O)2] и [Fe(NH3)5(NO2)]Cl2.
Сначала проанализируем состав комплексного соединения. В комплексном соединении содержится сложный комплексный ион, который показан в квадратных скобках. Комплексный ион состоит из комплексообразователя и лигандов. Комплексообразователь записывается первым в квадратной скобке, а далее следуют лиганды. Лигандами могут быть как заряженные частицы: I  , Cl
, Cl  , F
, F  , NO
, NO 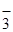 , NO
, NO 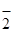 , OH
, OH  , CN
, CN  , SCN
, SCN  , так и нейтральные молекулы: Н2О, NH3. Количество лигандов вокруг комплексообразователя называется его координационным числом.
, так и нейтральные молекулы: Н2О, NH3. Количество лигандов вокруг комплексообразователя называется его координационным числом.
Комплексообразователь и лиганды связаны прочной ковалентной связью донорно-акцепторного типа. Комплексный ион является ионом внутренней сферы. Снаружи располагаются ионы внешней сферы. Ионы внешней и внутренней сферы связаны ионной связью.
Если сложный комплексный ион заряжен отрицательно, т.е. является анионом, то ион внешней сферы записывается слева, и комплекс называется анионным. Если комплексный ион заряжен положительно, т.е. представляет из себя катионный комплекс, то ион внешней сферы записывается справа. В некоторых соединениях ионы внешней сферы отсутствуют, тогда внутренняя сфера имеет нулевой заряд, такие комплексы называются нейтральными.
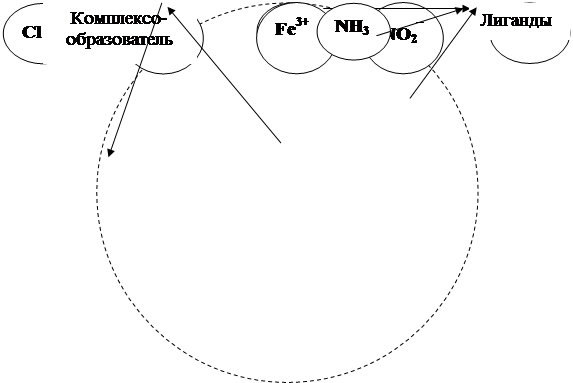
Учитывая степень окисления комплексных ионов (в первом соединении – [Co(SCN)4(H2O)2]1-, а во втором – [Fe(NH3)5NO2]2+, определяем, что первое соединение содержит анионный, а второе – катионный комплекс. Вокруг комплексообразователя Со3+ расположены лиганды: (SCN) 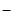 и (Н2О)0, их число равно 6, а вокруг Fe3+ – лиганды (NH3)0 и (NO2)–, их число также равно 6. Ионами внешней сферы в указанных соединениях являются ионы Na+ и Cl
и (Н2О)0, их число равно 6, а вокруг Fe3+ – лиганды (NH3)0 и (NO2)–, их число также равно 6. Ионами внешней сферы в указанных соединениях являются ионы Na+ и Cl 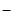 соответственно. Исходя из вышесказанного данные комплексные соединения могут быть представлены следующими схемами (рис. 2.6 а, 2.6 б):
соответственно. Исходя из вышесказанного данные комплексные соединения могут быть представлены следующими схемами (рис. 2.6 а, 2.6 б):
 |  | ||||||||
 |  |  | |||||||
Лиганды
 | 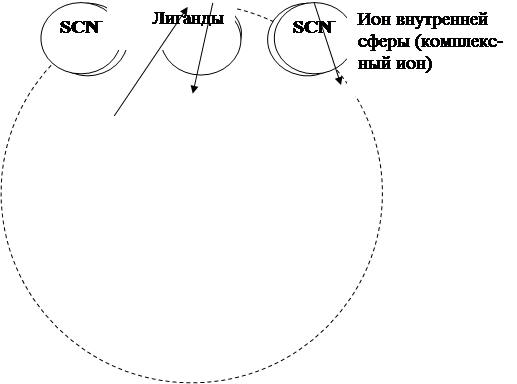 | ||
Рис. 2.6 а. Схема комплексного соединения Na[Co(SCN)4(H2O)2] –
– диаквотетрароданокобальтат (III) натрия
 |
 |  | ||
 |
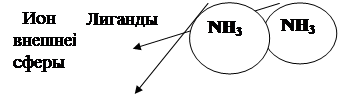
Рис. 2.6 б. Схема комплексного соединения [Fe(NH3)5 NO2]Cl2 –
– дихлорид нитритопентаамминожелеза (III)
Так как между ионами внешней и внутренней сферы действует слабая ионная связь, то в растворе под действием молекул воды эта связь разрывается, т.е. происходит диссоциация молекулы комплексного соединения на ионы внешней и внутренней сферы:
Na[Co(SCN)4(H2O)2]  Na+ + [Co(SCN)4(H2O)2]
Na+ + [Co(SCN)4(H2O)2]  ;
;
[Fe(NH3)5NO2]Cl2  [Fe(NH3)5NO2]2+ + 2Cl
[Fe(NH3)5NO2]2+ + 2Cl  .
.
Однако комплексный ион при этом сохраняет свою целостность. Комплекс перестает существовать, если разрывается внутренняя связь между комплексообразователем и лигандами.
Используя данную информацию, представим в виде табл. 2.3 характеристики двух комплексных соединений. Следует иметь в виду, что необходимо указывать все степени окисления частиц, составляющих данное соединение.
Заряд комплексообразователя определяют исходя из зарядов ионов внешней сферы, лигандов, их количества и нейтральности молекулы в целом. Определим заряд комплексообразователя для рассматриваемых комплексных соединений.
Na+[Cox(SCN) 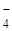 (H2O)
(H2O) 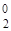 ] [Fex(NH3)
] [Fex(NH3) 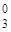 (NO
(NO 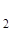 )–]Cl
)–]Cl 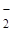
1+ х + 4(-1) + 2·0 = 0 х + 0·5 + (-1) + (-1)·2 = 0
х = +3 х = +3
Следовательно, комплексообразователем в 1-ом соединении является Со3+, а во втором – Fe3+.
Таблица 2.3
| Характеристики комплексного | Формула комплексного соединения | |
| соединения | Na[Co(SCN)4(H2O)2] | [Fe(NH3)5NO2]Cl2 |
| Комплексное соединение с ука-занием степеней окисления всех частиц | Na+[Cox(SCN) 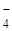 (H2O) (H2O) 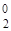 ] ] | [Fex(NH3) 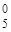 NO NO 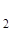 –]Cl –]Cl 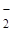 |
| Комплксообра- зователь | Со3+ | Fe2+ |
| Лиганды | SCN  , H2O0 , H2O0 | NH 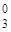 , (NO2)– , (NO2)– |
| Координационное число | 4 + 2 = 6 | 5 + 1 = 6 |
| Ионы внутренней сферы | [Co(SCN)4(H2O)2]  | [Fe(NH3)5NO2]2+ |
| Ионы внешней сферы | Na+ | Cl  |
| Уравнение диссоциации комплексного соединения | Na[Co(SCN)4(H2O)2]   Na+ + [Co(SCN)4(H2O)2] Na+ + [Co(SCN)4(H2O)2]  | [Fe(NH3)5(NO2)]Cl2   [Fe(NH3)5(NO2)]2+ + 2Cl [Fe(NH3)5(NO2)]2+ + 2Cl  |
Таблица II.1.
| Номер варианта | Формулы молекул | |
| CaCl2 | NF3 | |
| CdF2 | PH3 | |
| CuCl2 | SbBr3 | |
| MgBr2 | AsCl3 | |
| ZnI2 | H2S | |
| BeH2 | SCl2 | |
| HgCl2 | OF2 | |
| SrBr2 | H2Se | |
| BCl3 | H2Te | |
| AlH3 | SF2 | |
| GaBr3 | SiH4 | |
| CuF2 | CH4 | |
| SrBr2 | Cl2 | |
| CoCl2 | GeH4 | |
| MgBr2 | CH3Cl | |
| HgF2 | SiCl4 | |
| CaBr2 | CH2Cl2 | |
| CdCl2 | SiF4 | |
| ZnF2 | PbBr4 | |
| BeI2 | PBr3 | |
| ZnCl2 | SbCl3 | |
| CdH2 | AsBr3 | |
| MgH2 | SbF3 | |
| CaH2 | SnCl4 | |
| SrH2 | CF4 | |
| ZnBr2 | CHCl3 | |
| GaH3 | CCl4 | |
| AlH3 | SnBr4 | |
| InCl3 | H2Te | |
| ZnH2 | PbCl4 |
Таблица II.2
| Номер варианта | Формулы комплексных соединений | |
| K 2 [PtCl6] | [Co(NH3)5SO4]NO3 | |
| Na2[Cu(CN)4] | [Co(H2O)2(NH3)4]Cl2 | |
| (NH4)3[RhCl6] | [Cr(H2O)4Cl2]Br | |
| K3[CoF6] | [Pd(NH3)3Cl]Cl | |
| Na[Ag(NO3)2] | [Pt(NH3)3Cl]Br | |
| K2[Cd(CN)4] | [Co(NH3)5Br]SO4 | |
| Na3[V(SCN)6] | [Pd(H2O)(NH3)2Cl]Cl | |
| K[Ag(CN)2] | [Co(NH3)5H2O]Cl3 | |
| K4[Mn(CN)6] | [Ti(H2O)4Br2]Br | |
| K2[NiCl4] | [Cu(H2O)3OH]Cl | |
| (NH4)3[Fe(CN)6] | [Hg2(H2O)OH]Cl | |
| H[AuCl4] | [Co(NH3)5Cl]Cl2 | |
| K3[Al(OH)6] | [Be(H2O)3OH]Cl | |
| K2[Zn(CN)4] | [Ni(H2O)6]SO4 | |
| Na3[Co(NO2)6] | [Pt(NH3)2(H2O)(OH)]NO3 | |
| Ba[Cr(NH3)2(SCN)4]2 | [Cu(NH3)4](NO3)2 | |
| (NH4)2[Pt(OH)2Cl4] | [Al(H2O)6]Cl3 | |
| K2[Co(NH3)2(NO2)4] | [Zn(NH3)4]Cl2 | |
| K2[Pt(OH)5Cl] | [Ag(NH3)2]NO3 | |
| Na2[IrCl6] | [Cr(H2O)5(OH)]Cl2 | |
| K2[Zn(OH)4] | [Fe(H2O)5NO2]SO4 | |
| Na[Al(OH)4(H2O)2] | [Co(NH3)6]Cl3 | |
| K2[HgI4] | [Ti(H2O)4(OH)2]Cl2 | |
| K2[Ni(CN)4] | [Cr(NH3)2(H2O)4](NO3)3 | |
| Na2[Be(OH)4] | [Cr(NH3)4(SCN)Cl](NO3)2 | |
| K4[Cd(OH)6] | [Pt(NH3)2(H2O)2Br2]Cl2 | |
| Na[Cr(H2O)4Cl2] | [Ag(NH3)2]Br | |
| K2[Fe(H2O)Cl5] | [Ni(NH3)6](NO3)2 | |
| Na2[PtBr4] | [Zn(NH3)2Cl]Cl | |
| K[PtNH3Cl3] | [Fe(H2O)6]Cl3 |
Тема III. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Задание 3. 1. Запишите реакцию взаимодействия указанного по варианту элемента с кислородом. Используя приведенные в табл. III.1 данные, рассчитайте энтальпию образования оксида.
 2015-06-05
2015-06-05 4419
4419








