В основе современной спектроскопии лежит квантовая теория, согласно которой атомы могут обладать только строго определенными дискретными запасами внутренней энергии: Е o, Е 1, Е 2и т. д. Уровень с наименьшей энергией называют основным или нормальным состоянием (уровнем) – Е о, а все другие – возбужденными. Испускание света атомами происходит за счет изменения их энергии.
Если к атому в невозбужденном (нормальном) состоянии с минимальной энергией Е 0подвести энергию (например, в результате столкновения с быстролетящими электронами, энергия которых достаточна для возбуждения), то атом возбуждается, т. е. переходит на более высокий энергетический уровень: Е 1, Е 2и т. д. Через короткое время (~10–8 с) атом самопроизвольно возвращается в нормальное или какое-то более низкое возбужденное состояние. Освобождающаяся при этом энергия ∆Е излучается в виде светового кванта ∆Е = hν. Каждому переходу соответствует монохроматическая спектральная линия, которая характеризуется частотой ν
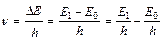 (1.1)
(1.1)
или волновым числом 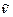
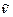
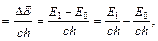 (1.2)
(1.2)
где E 1и E 0 – энергия атома в возбужденном и нормальном состояниях.
Спектр, обусловленный переходами частиц из состояния с большей энергией в состояние с меньшей энергией, называют спектром испускания. Спектры, испускаемые термически возбужденными частицами, называют эмиссионными. Эмиссионный спектр – это распределение интенсивностей испускания термически возбужденных частиц по длинам волн.
Линии в спектре, соответствующие переходам между первым возбужденным уровнем и основным, являются наиболее интенсивными и называются резонансными.
Атомные спектры характеризуются линейчатой структурой. Они состоят из большого числа дискретных спектральных линий, объединенных в отдельные спектральные серии. Положение линий в пределах каждой серии подчиняется определенным закономерностям.
|
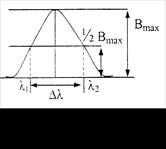 1.1).
1.1).
Основными характеристиками спектральной линии являются: частота (ν, с–1), длина волны (λ, нм), волновое число (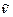 ,см–1), интенсивность и ширина. Первые три характеристики взаимосвязаны: ν. λ = с;
,см–1), интенсивность и ширина. Первые три характеристики взаимосвязаны: ν. λ = с; 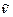
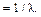 Под интенсивностью в спектре испускания понимают энергию, переносимую излучением в единицу времени. Шириной спектральной линии (∆λ, нм или ∆ν, с–1) называют ширину ее контура, измеренную на половине максимального значения интенсивности – Вmах (рис. 1.1).
Под интенсивностью в спектре испускания понимают энергию, переносимую излучением в единицу времени. Шириной спектральной линии (∆λ, нм или ∆ν, с–1) называют ширину ее контура, измеренную на половине максимального значения интенсивности – Вmах (рис. 1.1).
Спектры индивидуальных атомов можно наблюдать только в газовой фазе при относительно небольших давлениях. Устройства, в которых вещество переводится в атомарное состояние в газовой фазе, называют атомизаторами. В плазме источника света наиболее вероятны неупругие соударения атомов с быстрыми частицами (электронами, атомами, ионами), имеющими достаточную кинетическую энергию, называемые ударами первого рода. При этом часть этой кинетической энергии, равная по величине энергии возбуждения, передается атому, который переходит в возбужденное состояние.
Рассмотрим два электронных уровня с энергиями En (нижний) и Еm (верхний). Переход m→n ведет к испусканию (эмиссии) электромагнитного излучения с частотой
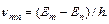
Пусть концентрация атомов (число атомов в единице объема) в состоянии Еn равна Nn, а в состоянии Еm – Nm. Тогда число спонтанных s переходов в единице объема в единицу времени определяется выражением:
s = Nm.Amn.
Коэффициент, равный отношению числа фотонов s, спонтанно (самопроизвольно) испущенных за единицу времени, к числу частиц, находящихся в возбужденном состоянии Nm, называют вероятностью спонтанного излучения, или коэффициентом Эйнштейна (Amn)для спонтанного испускания. Интенсивность спектральной линии Imn, соответствующей спонтанному переходу с уровня m на уровень n, равна:
Iтn = hνтn . Amn . Nm, (1.3)
где hνтn – энергия кванта;
Amn – коэффициент Эйнштейна;
Nm –концентрация атомов в возбужденном состоянии.
В атомизаторе при высокой температуре происходит плавление, испарение вещества, диссоциация молекул на атомы и возбуждение последних в результате соударений с высокотемпературными частицами.
В большинстве источников света эмиссионного спектрального анализа, работающих при атмосферном давлении, плазма находится в состоянии локального термодинамического равновесия (ЛТР). Это значит, что при большой плотности паров частота упругих столкновений всех частиц плазмы (атомы, молекулы, ионы, электроны) между собой так велика, что между ними происходит полный и беспрепятственный обмен кинетической энергией. В результате плазму можно характеризовать одним значением температуры Т. При термодинамическом равновесии заселенность возбужденных уровней описывается уравнением Больцмана:
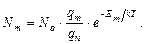 (1.4)
(1.4)
Выражение (1.3) для интенсивности линии при спонтанном переходе с уровня т на уровень n c учетом (1.4) приобретает следующий вид:
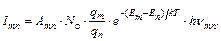 (1.5)
(1.5)
где Imn – интенсивность линии при переходе электрона с уровня т на уровень n;
N o и Nm – концентрация атомов в основном и возбужденном состояниях;
qm, qn – статистические веса, характеризующие степень вырождения соответствующих уровней;
Em и En –энергии уровней m и n;
Amn – вероятность спонтанного испускания при переходе с уровня m на уровень n;
hνmn –энергия кванта;
T – равновесная температура, К;
k – постоянная Больцмана 1,3807.10–23 Дж.К–1.
Из уравнения (1.5) в предположении постоянства Т, казалось бы, вытекает прямо пропорциональная зависимость интенсивности линии I от количества атомов N m, которое непосредственно связано с концентрацией элемента в пробе. Однако на величину I влияют процессы ионизации атомов и самопоглощения, искажающие эту зависимость.
Ионизация атомов (М ↔ М+ + ē) приводит к уменьшению числа излучающих частиц (возбужденных атомов). Равновесие реакции ионизации смещается вправо при снижении концентрации вещества в газовой фазе, а также при повышении температуры. Поэтому с повышением температуры интенсивность спектральной линии сначала возрастает в соответствии с (1.5), а затем уменьшается. С учетом ионизации интенсивность спектральной линии определяется по уравнению
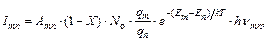 (1.6)
(1.6)
где Х – степень ионизации, которая количественно выражается отношением числа ионов (N +) к общему числу частиц, заполняющих дуговой разряд
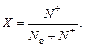 (1.7)
(1.7)
Уравнение (1.6) включает практически все параметры, от которых зависит интенсивность спектральной линии. Оно лежит в основе всех вариантов метода АЭС: пламенной спектроскопии (фотометрии пламени), спектрографического и спектрометрического методов.
 2015-06-04
2015-06-04 690
690








