Ответ подтвердить расчетом 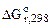 по
по 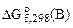 .
.
| Дано: Cr2O3; Zn; Si | РЕШЕНИЕ:
а) Составляем уравнение реакции и рассчитываем стандартное изменение энергии Гиббса 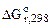 вреакции, используя I следствие из закона Гесса. Значения стандартных энергий Гиббса образования веществ вреакции, используя I следствие из закона Гесса. Значения стандартных энергий Гиббса образования веществ 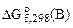 берем из таблицы
cтандартных термодинамических величин. берем из таблицы
cтандартных термодинамических величин.
|
| Cr -? |
Cr2O3(к) + 3Zn(к) = 2Сr(к) + 3ZnO(к) (15.1)
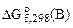 -1058,97 0 0 3(-320,7)
-1058,97 0 0 3(-320,7)
кДж/моль
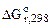 (15.1) = [
(15.1) = [ 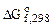 (ZnO(к)) + 2
(ZnO(к)) + 2 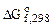 (Сr(к))] –
(Сr(к))] –
- [ 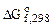 (Cr2O3(к)) + 3
(Cr2O3(к)) + 3 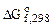 (Zn(к))] = 3(-320,7) -
(Zn(к))] = 3(-320,7) -
-(-1058,97) = 96,87 кДж
Так как 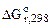 (15.1) > 0, то при стандартных условиях реакция невозможна.
(15.1) > 0, то при стандартных условиях реакция невозможна.
б) Аналогично:
2Cr2O3(к) + 3Si(к) = 4Сr(к) + 3SiО2(к) (15.2)
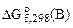 2(-1058,97) 0 0 3(-856,7)
2(-1058,97) 0 0 3(-856,7)
кДж/моль
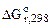 (15.2) = [3
(15.2) = [3 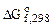 (SiO2(к)) + 4
(SiO2(к)) + 4 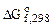 (Cr(к))] -
(Cr(к))] -
-[2 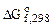 (Cr2O3(к)) + 3
(Cr2O3(к)) + 3 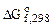 (Si(к))] = 3(-856,7) –
(Si(к))] = 3(-856,7) –
-2(-1058,97) = -452,16 кДж
Так как 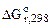 (15.2) < 0, то самопроизвольное протекание реакции при стандартных условиях возможно.
(15.2) < 0, то самопроизвольное протекание реакции при стандартных условиях возможно.
Ответ: При стандартных условиях возможно восстановление хрома из оксида хрома (III) кремнием.
2. Определить рН раствора, при котором установилось равновесие: 2CrO 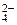 + 2H+ <=> Cr2O
+ 2H+ <=> Cr2O 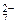 + H2O Равновесные концентрации ионов Cr2O
+ H2O Равновесные концентрации ионов Cr2O 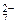 и CrO
и CrO 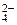 соответственно равны 4,5 моль/л и 0,001 моль/л. Константа равновесия Кс = 1,1·1018.
соответственно равны 4,5 моль/л и 0,001 моль/л. Константа равновесия Кс = 1,1·1018.
Дано:
[Cr2O 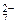 ]=4,5 моль/л
[CrO ]=4,5 моль/л
[CrO 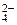 ]=0,001 моль/л
Кс = 1,1·1018 ]=0,001 моль/л
Кс = 1,1·1018
|
| рН -? |
РЕШЕНИЕ:
2CrO 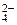 + 2H+ <=> Cr2O
+ 2H+ <=> Cr2O 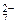 + H2O
+ H2O
рН = -lg[H+]
Kc = 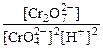
[H+] = 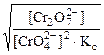 = =
= = 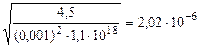 моль/л
моль/л
рН = -lg2,02·10-6 = 5,7
Ответ: рН = 5,7
3. Шестивалентный элемент взаимодействуя с кислородом при н.у., образует оксид, содержащий 20,71% масс. кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.

| РЕШЕНИЕ:
По закону эквивалентов:
nэк(О2) = nэк(Э)
 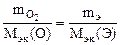 Мэк(О) = 8 г/моль
Мэк(О) = 8 г/моль
|
Мэк(Э) = 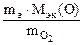
mокс = mэ + 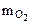
mэ = 100 - 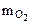 = 100 – 20,71 = 79,29 г.
= 100 – 20,71 = 79,29 г.
Мэк(Э) = 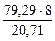 = 30,63 г/моль
= 30,63 г/моль
Мэк(Э) = 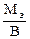 , где В – валентность элемента.
, где В – валентность элемента.
Мэ = Мэк(Э)∙В = 30,63∙6 = 183,77 г/моль, что соответствует молекулярной массе атома вольфрама.
Ответ: Мэк(Э) = 30,63 г/моль; элемент – W.
 2015-06-05
2015-06-05 492
492

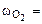 20,71% масс.
В = 6
Мэк(Э) -?
Э -?
20,71% масс.
В = 6
Мэк(Э) -?
Э -?







