Дано: с 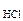 = 0,02 M с = 0,02 M с 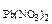 = 0,05 M V = 0,05 M V 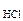 = V = V 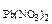 |
| Образуется ли осадок-? |
РЕШЕНИЕ:
При сливании растворов протекает следующая реакция:
Pb(NO3)2 + 2HCl= PbCl2  + 2HNO3
+ 2HNO3
Осадок PbCl2 образуется только в случае, если
с 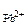 ·с
·с 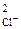 > ПР
> ПР 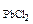 = 2·10
= 2·10 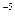 (табл.)
(табл.)
С учетом увеличения объема раствора при сливании в 2 раза:
с 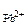 =
= 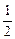 с
с 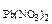 ·
· 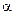 ·n
·n 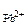 =
= 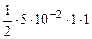 = 2,5·10-2 моль/л
= 2,5·10-2 моль/л
с 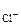 =
= 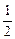 с
с 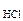 ·
· 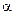 ·n
·n 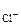 =
= 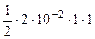 = 1·10-2 моль/л
= 1·10-2 моль/л
с 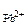 ·с
·с 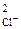 = 2,5·10
= 2,5·10 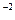 ·(1·10
·(1·10 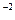 )2 = 2,5·10
)2 = 2,5·10 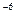
Так как 2,5·10 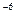 < 2·10-5 (ПР
< 2·10-5 (ПР 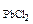 ), то осадок PbCl2 не образуется.
), то осадок PbCl2 не образуется.
Ответ: осадок PbCl2 не образуется.
3. Составить схему коррозионного ГЭ, возникающего при контакте оловянной пластинки, площадью 35 см2 с медной в растворе хлороводородной кислоты. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 70 минут в процессе коррозии выделилось 1,5 см3 газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 80 минут потеря массы корродируемого металла составила 5,6 ∙10-3 г. Плотность металла 7,3 г/см3.
РЕШЕНИЕ:
По таблице находим значения стандартных электродных потенциалов олова (II) и меди (II):
|
|
|
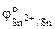 = - 0,14 В,
= - 0,14 В, 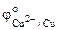 = 0,34 В.
= 0,34 В.
Так как 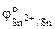 <
< 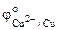 , то анодом в коррозионном ГЭ будет олово, катодом – медь.
, то анодом в коррозионном ГЭ будет олово, катодом – медь.
Составим схему коррозионного ГЭ:
А(-)Sn │ HCl │ Cu(+)K
или
А(-)Sn │ H+ │ Cu(+)K
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A(-)Sn – 2ē = Sn2+
На К(+)2Н+ + 2ē = Н2

Sn + 2H+ = Sn2+ + H2
Sn + 2HCl = SnCl2 + H2 – суммарная реакция процесса коррозии.
а)

| Рассчитываем объемный показатель коррозии (KV) по формуле: KV =  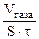 , см3/м2∙час. При расчете KV принимаем: S – площадь поверхности анода, м2; τ – время процесса коррозии, час; Vгаза – объем выделившегося газа, см3. , см3/м2∙час. При расчете KV принимаем: S – площадь поверхности анода, м2; τ – время процесса коррозии, час; Vгаза – объем выделившегося газа, см3. |
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород. Следовательно, Vгаза = 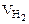 .
.
Тогда, KV = 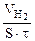 =
= 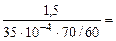 367,3 см3/м2∙час.
367,3 см3/м2∙час.
Рассчитываем весовой показатель коррозии Km по формуле:
Km = 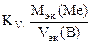 , г/м2∙час.
, г/м2∙час.
В процессе коррозии разрушению подвергается олово и выделяется водород.
Следовательно:
Мэк(Ме) = Мэк(Sn) = 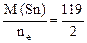 =59,5 г/моль,
=59,5 г/моль,
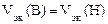 = 11200 см3/моль.
= 11200 см3/моль.
Km = 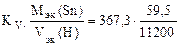 = 1,95 г/м2∙час.
= 1,95 г/м2∙час.
Ответ: KV = 367,3 см3/м2∙час.
Km = 1,95 г/м2∙час.
б)
 | Рассчитываем весовой показатель коррозии Km по формуле: Km =  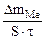 , г/м2∙час. Коррозии подвергается олово. Тогда потеря массы металла , г/м2∙час. Коррозии подвергается олово. Тогда потеря массы металла 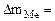 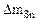 |
При расчете Km принимаем: 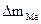 - [г]; S – [м2], τ - [час].
- [г]; S – [м2], τ - [час].
Тогда: Km = 
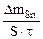 =
= 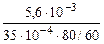 = 1,2 г/м2∙час.
= 1,2 г/м2∙час.
Рассчитываем глубинный показатель коррозии по формуле:
П = 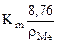 =
= 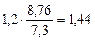 мм/год.
мм/год.
Ответ: Km = 1,2 г/м2∙час, П = 1,44 мм/год.
 2015-06-05
2015-06-05 3603
3603








