1. Толстый миофиламент
2. Молекулы миозина
3. Головки миозина
4. Тонкий миофиламент
5. Молекулы актина
6. Тропомиозин
7. Тропониновый комплекс
Сократительный аппарат мышечного волокна представлен миофибриллами – специальными органеллами, имеющими вид нитей диаметром 1-2 мкм. Они располагаются продольно в центральной части саркоплазмы. Миофибриллы состоят из тонких актиновых (диаметр 5 нм) и толстых миозиновых (диаметр 12 нм) филаментов. В состав актиновых филаментов входит белок актин, а также белки тропонин и тропомиозин. Молекулы актина имеют глобулярное строение и, соединяясь вместе, образуют длинные цепи. В актиновых филаментах таких цепей две, они образуют двойную спираль. В бороздках между цепями актина лежат молекулы тропомиозина, также образуя две спирали. К молекулам тропомиозина на равных расстояниях друг от друга прикрепляются молекулы тропонина. Тропониновый комплекс состоит из трех глобулярных субъединиц: TnT, TnC и TnI. TnT осуществляет прикрепление тропонинового комплекса к тропомиозину. TnC связывается с ионами кальция. TnI препятствует взаимодействию миозиновых головок с актином.
Толстые филаменты образованы упорядоченно упакованными молекулами фибриллярного белка миозина. Каждая молекула миозина состоит из двух частей: головки и хвоста и может сгибаться в двух местах (шарнирные участки). Головки миозина проявляют ферментативную активность и способна расщеплять АТФ, энергия которой идет на сокращение. Хвостовыми частями молекулы миозина соединяются в пучки и формируют толстый филамент. Головки миозина торчат наружу.
В покое при низкой концентрации ионов Са2+ миозиновые головки не могут взаимодействовать с участками связывания на молекуле актина, потому что они прикрыты тропонин-тропомиозиновым комплексом. Мышечное сокращение вызывается резким повышением концентрации ионов Са2+ в области миофиламентов. Взаимодействие актиновых и миозиновых филаментов при сокращении запускается ионами Са2+. Субъединица TnC тонкого миофиламента, связываясь с Са2+, подвергается конформационному изменению. Вследствие этого тропонин вдавливает тропомиозин глубоко в борозды актинового филамента и открывает участок связывания миозина на молекуле актина. Миозиновые головки связываются с актином.
Расслабление после мышечного сокращения происходит в результате снижения концентрации Са2+, тропонин возвращается в первоначальное конформационное состояние. Нити тропомиозина при этом вновь закрывают центры связывания на молекуле актина.
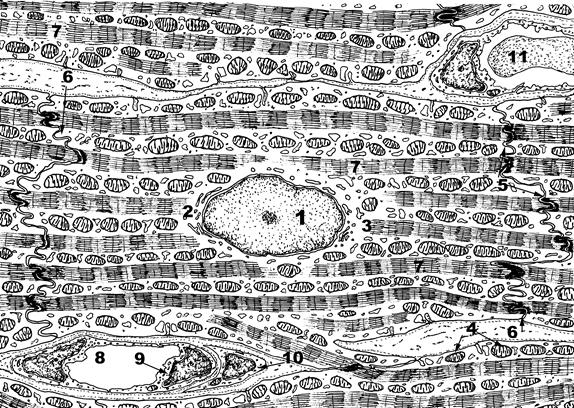
1. Фрагмент какой ткани на фотограмме?
2. Аргументируйте вывод?
3. Назовите структуры, обозначенные цифрами?
 2015-06-26
2015-06-26 4079
4079







