Роль каталитических реакций особенно велика в процессах жизнедеятельности организмов. Подавляющее большинство реакций, протекающих в живых организмах, осуществляются при участии биологических катализаторов, которые имеют общее название ферменты. Характерной особенностью ферментов является их специфичность.
Под специфичностью фермента понимается его свойство изменять скорость реакции одного типа и не влиять на многие другие реакции, протекающие в клетке.
В частности, пероксид водорода, образующийся как побочный интермедиат в процессе внутреннего дыхания клеток, разрушается ферментом каталазой. В отсутствие каталазы пероксид водорода разлагается медленно и накапливается в значительных количествах. Он взаимодействует с биоорганическими веществами клетки, окисляет их, что, в конечном счете, приводит к гибели клетки. Это свойство пероксида водорода используется для уничтожения патогенных микроорганизмов при обработке свежих ран.
Каталаза является типичным ферментом. В состав каталазы, как и большинства ферментов, входит ион металла. Поэтому эти биологические катализаторы называются металлоферментами. Химический анализ показывает, что в каждой молекуле каталазы имеется ион железа Fe2+. Этот факт не является неожиданным, поскольку именно ионы железа ускоряют разложение пероксида водорода. При обычных условиях разложение пероксида в присутствии ионов Fe2+ протекает примерно в 105 раз, а в присутствии каталазы в 1010 раз быстрее, чем некаталитическое разложение.
В общем виде ферментная реакция записывается:
S + E 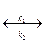 ES
ES 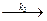 P + E,
P + E,
где S – субстрат; Е – фермент; ES – фермент-субстратный комплекс.
Данный процесс последовательный: 1 стадия быстро протекает, 2 стадия медленно протекает. 2 стадия называется молекулярной активностью фермента или числом оборота фермента.
Строгие экспериментальные доказательства рассмотренного механизма действия ферментов впервые получили Л.Михаэлис и М.Ментен (1913). Эти же ученые вывели формулу зависимости стационарной скорости ферментативной реакции υ от концентрации субстрата (уравнение Михаэлиса-Ментен):
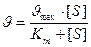 ,
,
где Km – константа Михаэлиса, численно равная такой концентрации субстрата, при которой скорость равна половине максимальной.
При малых концентрациях субстрата: [S] << Km. Уравнение приобретает вид: 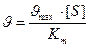 реакция протекает по первому порядку.
реакция протекает по первому порядку.
При больших концентрациях субстрата: [S] >> Km. Уравнение приобретает вид:
υ = υmax, отсюда следует, что при больших концентрациях субстрата скорость ферментативного процесса достигает максимального значения и не зависит от величины концентрации субстрата.
 2015-06-26
2015-06-26 529
529







