| Порядок реакции | Примеры | Кинетическое уравнение | Константа скорости реакции | Время полуреакции |
| Фотохимические реакции, ферментативные реакции при высокой концентрации фермента | υ = k∙[A]o = k υ = k | 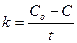 | 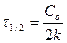 | |
| Радиоактивный распад радионуклидов | υ = k∙[A]1 | 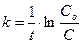 | 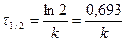 | |
| Реакции гидролиза сложных эфиров, жиров, углеводов, белков и солей | υ = k∙[A]2 | 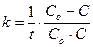 | 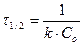 |
Часто наряду с порядком реакции выделяют и молекулярность реакции. Молекулярность – это число молекул (частиц), принимающих участие в элементарном акте химического взаимодействия. Если превращение испытывает одна молекула, то это мономолекулярная реакция, две – бимолекулярная, три – тримолекулярная. Порядок и молекулярность совпадают только для простых реакций.
Пример реакции 1-го порядка и одновременно мономолекулярной:
H2S2O3 = H2O + SO2 + S, V = k 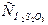 .
.
Бимолекулярная реакция гидролиза сахарозы также описывается кинетическим уравнением первого порядка:
С12Н22О11 + Н2О = 2С6Н12О6, V = k 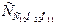
В этой реакции принимают участие две молекулы, одна из которых принадлежит растворителю (Н2О), концентрация которого практически не изменяется, а, следовательно, и не влияет на скорость реакции, т.е. скорость реакции зависит от концентрации только одного вещества – сахарозы.
Более часто встречаются реакции второго порядка. Например, приведенные ниже реакции являются реакциями второго порядка и одновременно бимолекулярными:
H2 + I2 = 2HI, V = k 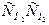
2Cl2O = 2Cl2 + O2, V = k 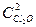
 2015-06-26
2015-06-26 982
982







