Електронна спектроскопія – оптична спектроскопія (як і ІЧ), що базується на реєстрації поглинання чи емісії електромагнітного випромінювання в діапазоні 10-780 нм (УФ і видима область). Поглинання чи випромінювання в даній області обумовлене електронними переходами, тобто переходами електронів молекули із одних енергетичних рівнів на інші. Також тут знаходяться електронно-коливальні смуги молекул, що в даних умовах приводять до розмитих спектрів. Тому молекулярні спектри на відміну від атомних мають вигляд широких (десятки нм) смуг, а не лінійчастий вигляд. Для органічних молекул справедливе одно електронне наближення, тобто 1 електрон з ВЗМО переходить на одну із вільних МО, найчастіше НВМО. Таким чином молекула переходить у збуджений стан з поглинанням світла, λ якого відповідає енергії, що дорівнює різниці енергій між даними МО. 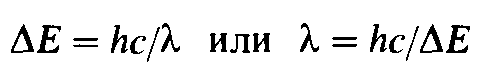 Це дозволяє використовувати ЕС для вивчення електронної будови молекул, впливу замісників, встановлення типу зв’язку та ін.. В основі цих досліджень лежить віднесення спектральних смуг до певних електронних переходів, враховуючи їх положення і інтенсивність. ЕС при довжині хвилі, меншій за 180-185 нм, називається «вакуумною» УФ, тому що в цій області випромінювання дуже сильно поглинається повітрям (в основному киснем), тому потрібно використовувати вакуумні чи
Це дозволяє використовувати ЕС для вивчення електронної будови молекул, впливу замісників, встановлення типу зв’язку та ін.. В основі цих досліджень лежить віднесення спектральних смуг до певних електронних переходів, враховуючи їх положення і інтенсивність. ЕС при довжині хвилі, меншій за 180-185 нм, називається «вакуумною» УФ, тому що в цій області випромінювання дуже сильно поглинається повітрям (в основному киснем), тому потрібно використовувати вакуумні чи
УФС при длине волны меньше 185 нм наз. вакуумной, т. к. в этой области УФ излучение настолько сильно поглощается воздухом (гл. обр. кислородом), что необходимо применять вакуумные или наполненные непоглощающим газом спектральные приборы.
8. Молекулярні орбіталі на прикладі етилену, бутадієну, формальдегіду. Зв’язуючі та антизв’язуючі МО. ВЗМО і НВМО. Довгохвильовий електронний перехід. Поняття про π-π та n-π переходи.
МО розглядаються як лінійна комбінація атомних орбіта лей (ЛКАО). Число МО дорівнює числу вихідних АО, тобто в результаті перекривання 2 АО утворюються 2 МО. Одна з них має меньшу енергію порівняно з вихідними АО (зв’язуюча МО), а інша МО має більшу енергію, ніж вихідні АО, і називається розрихляючою чи антизв’язуючою (позначається знаком *). МО, 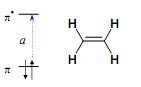 що не приймає участі в утворенні хімічного зв’язку, називається незв’язуючою. Остання МО, зайнята електронами в основному стані, називається вищою зайнятою МО (ВЗМО), а найближча вільна до неї із трохи більшою енергією – нижча вільна МО (НВМО). Існує значна різниця між енергіями ВЗМО і НВМО, що називається енергетичною щілиною.
що не приймає участі в утворенні хімічного зв’язку, називається незв’язуючою. Остання МО, зайнята електронами в основному стані, називається вищою зайнятою МО (ВЗМО), а найближча вільна до неї із трохи більшою енергією – нижча вільна МО (НВМО). Існує значна різниця між енергіями ВЗМО і НВМО, що називається енергетичною щілиною.
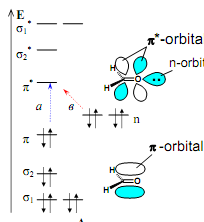
В органічних молекулах частіше за все зустрічаються переходи π → π*, n → π*, n → σ*, а також різні переходи із переносом заряду. Переходи типу π → π* найбільш характерні для молекул із системою спряжених зв’язків. При цьому відбувається перехід електрону з ВЗМО на НВМО. Збільшення системи спряження приводить до червоного (батохромного, довгохвильового) зсуву в довгохвильову область спектру переходів типу π → π*. Це пояснюється зменшенням різниці в енергіях між ВЗМО і НВМО при збільшенні системи спряження (відбувається зниження енергії НВМО і підвищення для ВЗМО, це помітно при порівнянні МО етилену і бутадієну). Переходи n → π* типу характерні для молекул, до складу яких входять гетеро атоми, з’єднані подвійним зв’язком (C=N, C=O, C=S, N=N, N=O). Інтенсивність таких переходів мала, так як вони заборонені геометрично: слабке перекривання в просторі між ВЗMO (орбіталь n-типу) і НВMO (орбіталь π-типу). Переходи n → π* типу зазвичай безвипромінювальні.
 2015-06-28
2015-06-28 874
874








