Одною з найважливіших задач, яка стояла перед квантовою теорією атома, було пояснення того факту, що при монотонному зростанні порядкового номера елемента Z хімічні і оптичні властивості елементів періодично повторюються. Крім того енергія основного стану атомів різних речовин виявилася суттєво різною. Пояснення вказаних фактів грунтується на загальному принципі, запропанованому В. Паулі (1900 – 1958) в 1925 р., згідно якого в любій фізичній системі не може бути двох електронів з однаковими квантовими числами або в любій фізичній системі не може бути більше одного електорна з заданими квантовими числами. Стан кожного електрона в атомі характеризується чотирма квантовими числами:
1. Головне квантове число – n із значеннями 1. 2, 3....
2. Орбітальне квантове число – l (всього значень n) із значеннями 0. 1, 2, 3...(n-1).
3. Магнітне квантове число – m (всього значень (2 l+1)) із значеннями 0, ±1, ±2...± l (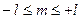 ).
).
4. Спінове квантове число – s із значенням ±1/2.
Наслідком принципа Паулі є кінцева кількість електронів в станах, які визначаються однаковими головними квантовими числами, що утворюють так звані електронні шари.
Визначемо число електронів в кожному шарі, з врахуванням принципа Паулі:
| шар | n | l | m | s | кільк. ел. | стан | кільк. ел. в стані | кільк. ел. в шарі |
| K | ±1/2 | s | ||||||
| L | ±1/2 | s | ||||||
| +1 -1 | ±1/2 ±1/2 ±1/2 | p p p | ||||||
| M | ±1/2 | s | ||||||
| +1 -1 | ±1/2 ±1/2 ±1/2 | p p p |
В загальному випадку, для даного значення головного квантового числа n кількість різних станів буде
N=2n2 (3.25)
Об’єднуючи принцип Паулі з загальним принципом стремління системи до найменшої енергії, можна пояснити порядок заповнення електронами можливих станів в атомі, і відповідно пояснити хімічні властивості атомів.
 2015-06-28
2015-06-28 438
438








