2.1. Явление электролиза.
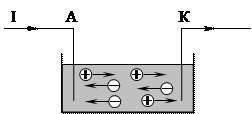
В электролитах свободными зарядами являются положительные и отрицательные ионы. Опустим в сосуд, содержащий электролит, две металлические или угольные пластинки, соединённые с источником Е. Д. С. (рис. 1) и называемые электродами. Электрод, соединённый с положительным полюсом источника, называется анодом, соединённый с отрицательным полюсом источника – катодом. Сосуд, содержащий электролит и электроды называется
электролитической ванной (или
вольтаметром).
При замыкании цепи анод заряжается положительно, катод – отрицательно, и между ними образуется электрическое поле. Под действием силы поля отрицательные ионы движутся к аноду, а положительные – к катоду (рис. 2). Поэтому отрицательные ионы получили название
анионов, а положительные –
катионов. Достигнув катода, катионы присоединяют к себе избыточные электроны катода и превращаются в нейтральные атомы. Эти атомы или образовавшиеся из них молекулы откладываются на электродах, покрывая их слоев вещества. Выделение вещества на электродах при прохождении электрического тока через электролит называется
электролизом.
Нередко прохождение электрического тока через электролиты сопровождается химическими превращениями вещества. Рассмотрим, например, электролиз водного раствора серной кислоты. При диссоциации молекула серной кислоты распадается на положительный ион водорода и отрицательный ион кислотного остатка:
 H2SO4 2H+ + SO4- -,
H2SO4 2H+ + SO4- -,
причём каждый из ионов несёт заряд, численно равный элементарному заряду. Оказывается, что небольшая часть молекул воды также диссоциирована на ионы, а именно: на положительный ион водорода и отрицательный ион гидроксида:
 H2O H+ + OH-.
H2O H+ + OH-.
При замыкании электрической цепи все ионы водорода движутся к катоду, а отрицательно заряженные ионы OH- и SO4-- к аноду. Ионы водорода отнимают у катода электроны и превращаются в нейтральные атомы, которые соединяются в молекулы H2 и выделяются из раствора. Анод отбирает лишние электроны у подошедших к нему ионов OH-, так как силы, удерживающие электроны в ионах гидроксида, значительно меньше, чем силы, удерживающие электроны в ионах SO4--. При разрядке ионов OH- образуются молекулы воды и молекулы кислорода, который и выделяется из раствора. Таким образом, в растворе образуются следующие ионы:
 H2SO4 2H+ + SO4--,
H2SO4 2H+ + SO4--,
 4H2O 4H+ + 4OH-.
4H2O 4H+ + 4OH-.
На катоде выделяется газообразный водород:
4H+ + 4 e = 2H2,
где e – заряд электрона.
На аноде SO4—остаются в растворе и, соединившись с ионами водорода, могут образовать молекулы H2SO4. В результате электролиза общее количество серной кислоты в растворе остаётся неизменным, а количество воды уменьшается.
Процесс, при котором вещество выделяется на обоих электродах, возможен лишь в том случае, когда электроды не растворяются в электролите.
Для электролитов справедлив закон Ома
 I
I =
где
R – сопротивление электролита, равное



R = ρ
Удельная электропроводимость γ данного электролита тем больше, чем большее число его молекул диссоциировано на ионы и с тем большей скоростью эти ионы движутся под действием электрического поля с данной напряжённостью. При нагревании сопротивлении электролитов уменьшается. Это объясняется двумя причинами: во-первых, с увеличением температуры возрастает кинетическая энергия молекул электролита, и при соударениях большее их число распадается на ионы; во-вторых, при нагревании жидкости уменьшается её внутреннее трение, а следовательно, скорость движения ионов увеличивается.
2.2. Законы электролиза Фарадея.
М. Фарадей исследовал явления происхождения электрического тока через электролиты и на основании опытов установил два основных закона электролиза.
Первый закон: масса m вещества, выделившаяся при электролизе на каждом из электродов, пропорциональна величине заряда q, прошедшего через электролит:
m = k q, (1)
где k – электрохимический эквивалент данного вещества. При q = 1k k = m, т.е. электрохимический эквивалент равен количеству вещества, выделившемуся на электроде при прохождении через электролит единицы заряда.
Так как q = I t, то
m = k I t.
Значения электрохимических эквивалентов для некоторых веществ приведены в приложении № 1.





































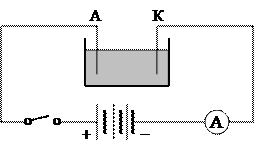
Первый закон Фарадея легко проверить на опыте. Включим три одинаковые электролитические ванны А, В и С, содержащие один и тот же электролит и имеющие одинаковые сопротивления, так, как показано на рис.3. Ток
I, протекающий через ванну А, разделится поровну между ваннами В и С. Измерив после опыта количества вещества, выделившиеся на анодах ванн В и С, мы убедимся, что каждая из масс m
B и m
C равна половине массы m
A, выделившейся на аноде ванны А. То же соотношение мы обнаружим и для масс вещества, выделившихся на катодах.
Второй закон: электрохимические эквиваленты элементов прямо пропорциональны их химическим эквивалентам:
 k = C
k = C 
Здесь
А – атомный вес элемента,
Z – его валентность. Отношение
 называется химическим эквивалентом вещества; С – величина постоянная, имеющая одно и тоже значение для всех веществ.
называется химическим эквивалентом вещества; С – величина постоянная, имеющая одно и тоже значение для всех веществ.
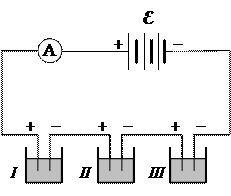
Проверим второй закон Фарадея экспериментально. Соединим последовательно несколько электролитических ванн, содержащих различные электролиты (рис. 4). Обозначим массу вещества, выделившегося на одном из электродов (например, на катоде) первой ванны,
m1, атомный вес этого вещества
A1 и его валентность
Z1, а соответствующие значения этих величин для вещества во второй ванне
m2, A2 и
Z2. По второму закону Фарадея,
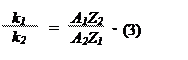
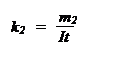
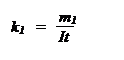
Но согласно первому закону Фарадея,


Подставим эти значения k
1 и k
2 в формулу (3). Так сила
I и время
t его прохождения через электролит одинаковы для обоих электролитов, то
Определим из опыта m1 и m2 и найдём значения A1, Z1, A2 и Z2. Повторим опыт со II и III вольтметрами, убедимся, что равенство (4) справедливо для любых двух веществ, выделившихся на электродах при электролизе в двух последовательно соединённых электролитических ваннах.
Оба закона Фарадея можно объяснить. Заменив в формуле (1) электрохимический эквивалент k согласно (2):
 m
m =
C q,




а - величиной
F (=
F),
называемой числом Фарадея; получим окончательно
m = (5)

Если в выражении (5)
объединённого закона Фарадея положить
q =
F, то m = Следовательно,
число Фарадея равно электрическому заряду, который должен пройти через электролит для выделения на электроде количества веществ, равного его химическому эквиваленту (одному грамм-эквиваленту).
Опытным путём установлено, что
F = 96 500 к/г-экв
Из законов Фарадея следует, что подобно тому, как вещество построено из отдельных атомов, электричество состоит из элементарных зарядов. Для выделения на электроде одного грамм-эквивалента вещества через электролит должен пройти
электрический заряд, равный числу Фарадея. В одном грамм-атоме одновалентного вещества содержится
NA атомов (
NA – число Авогадро). Поэтому на каждый ион одновалентного вещества приходится заряд

q =.
Оказалось, что
числено заряд q0 одновалентного иона в точности равен заряду с электрона: 
 q 0
q 0 =
e = =
k = 1.6 · 10
-19 k = 4.8 · 10
-10 СГСЭ
q

 В электролитах свободными зарядами являются положительные и отрицательные ионы. Опустим в сосуд, содержащий электролит, две металлические или угольные пластинки, соединённые с источником Е. Д. С. (рис. 1) и называемые электродами. Электрод, соединённый с положительным полюсом источника, называется анодом, соединённый с отрицательным полюсом источника – катодом. Сосуд, содержащий электролит и электроды называется электролитической ванной (или вольтаметром).
В электролитах свободными зарядами являются положительные и отрицательные ионы. Опустим в сосуд, содержащий электролит, две металлические или угольные пластинки, соединённые с источником Е. Д. С. (рис. 1) и называемые электродами. Электрод, соединённый с положительным полюсом источника, называется анодом, соединённый с отрицательным полюсом источника – катодом. Сосуд, содержащий электролит и электроды называется электролитической ванной (или вольтаметром).  H2SO4 2H+ + SO4- -,
H2SO4 2H+ + SO4- -, H2O H+ + OH-.
H2O H+ + OH-. H2SO4 2H+ + SO4--,
H2SO4 2H+ + SO4--, 4H2O 4H+ + 4OH-.
4H2O 4H+ + 4OH-. I =
I = 

 R = ρ
R = ρ 




































 k = C
k = C  Здесь А – атомный вес элемента, Z – его валентность. Отношение
Здесь А – атомный вес элемента, Z – его валентность. Отношение  называется химическим эквивалентом вещества; С – величина постоянная, имеющая одно и тоже значение для всех веществ.
называется химическим эквивалентом вещества; С – величина постоянная, имеющая одно и тоже значение для всех веществ.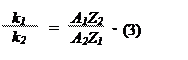
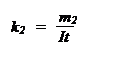
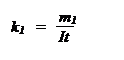 Но согласно первому закону Фарадея,
Но согласно первому закону Фарадея, 
 Подставим эти значения k1 и k2 в формулу (3). Так сила I и время t его прохождения через электролит одинаковы для обоих электролитов, то
Подставим эти значения k1 и k2 в формулу (3). Так сила I и время t его прохождения через электролит одинаковы для обоих электролитов, то 



 а - величиной F (= F), называемой числом Фарадея; получим окончательно
а - величиной F (= F), называемой числом Фарадея; получим окончательно  Если в выражении (5) объединённого закона Фарадея положить q = F, то m = Следовательно, число Фарадея равно электрическому заряду, который должен пройти через электролит для выделения на электроде количества веществ, равного его химическому эквиваленту (одному грамм-эквиваленту).
Если в выражении (5) объединённого закона Фарадея положить q = F, то m = Следовательно, число Фарадея равно электрическому заряду, который должен пройти через электролит для выделения на электроде количества веществ, равного его химическому эквиваленту (одному грамм-эквиваленту).  q =.
q =. 
 q 0 = e = = k = 1.6 · 10-19 k = 4.8 · 10-10 СГСЭ q
q 0 = e = = k = 1.6 · 10-19 k = 4.8 · 10-10 СГСЭ q  2015-06-28
2015-06-28 2531
2531
