Поскольку гены контролируют производство и синтез белков, то еще раз рассмотрим структуру белков. Как было сказано в гл. 3, белки — наиболее разнообразные молекулы организма. Они являются составной частью всех мембран; образуют большую часть рибосом («фабрик» по производству белков); входят в состав многих структурных частей клетки определяющих ее форму и строение; белки — активные компоненты мышечных волокон, позволяющих нам выполнять движения. Из белков состоят такие образования, как волосы, кожа, сухожилия и (в сочетании с кристаллами фосфата кальция и магния) кости. Белками являются некоторые гормоны, такие как инсулин, которые переносят химические послания от одного типа клеток к другим. И что самое важное, белки выполняют также функцию ферментов.
Вспомним, что белки представляют собой длинные цепи полимеров, состоящих из 20 видов аминокислот, соединенных друг с другом полипептидной связью. Связь образуется в ходе химических реакций, идущих с выделением воды в качестве побочного продукта. Полипептид может состоять из очень большого количества аминокислот. В наше время с помощью особых приборов можно быстро определить состав аминокислот в белке. Анализ белков показал, что каждый из них характеризуется уникальной последовательностью аминокислот, называемой первичной структурой. Все молекулы белков одного вида имеют одинаковую последовательность. Например, если обозначить аминокислоты по трем буквам их названия (латинского), то полипептид Glu—Gly— Pro—Trp—Leu—Glu—Ala— —Tyr—Gly—Trp—Met—Asp—Phe — это гормон гаст-рин, способствующий пищеварению, а полипептид Туг—Gly—Gly—Phe—Met — энкефалин, обладающий опиатным действием в нервной системе. Эти последовательности всегда записываются начиная с амин-ного конца, то есть со свободной аминогруппы, и заканчиваются карбоксильным концом, то есть свободной карбоксильной группой. Однако большийство других белков — очень большие молекулы, состоящие из нескольких сотен аминокислот; замена всего лишь одной кислоты может иногда привести к образованию совсем другого белка с другой структурой; чаще всего такая замена приводит к утрате функций белка.
Первичная структура, как правило, определяет свойства любого белка, включая то, как эти длинные цепи принимают особую форму в пространстве (рис. 6.2). Сила притяжения между атомами в каждой молекуле белка заставляет полипептидную цепь принимать специфическое положение, и так получается структура, способная выполнять ту или иную функцию — например, небольшой «карман» или активный центр, с помощью которого фермент катализирует химическую реакцию.
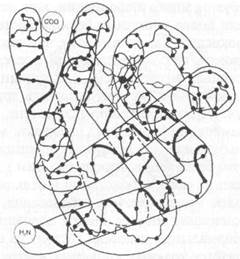
Рис. 6.2. Трехмерная структура белка миоглобина. Показаны не все атомы; жирной линией обозначен «каркас» пептидной цепи, который образуют несколько спиральных сегментов, соединенных цепями с менее регулярной формой
Многие функциональные белки, кроме того, состоят из двух полипептидов и более.
Когда говорят о генах, часто используют термин информация, особенно генетическая информация. Вспомним (гл. 3), что информация позволяет сделать выбор из нескольких возможных вариантов, что особенно важно для структуры белка. Так, упомянутая последовательность гастрина — это одна из 2013 возможных последовательностей из 20 видов аминокислот по 13 в ряд. Понятно, что для постройки этого белка требуется много информации, хотя не так много, как для более типичных белков, состоящих из 300 аминокислот. Где-то в геноме человека должен присутствовать ген, определяющий последовательность гастрина: он переносит информацию о том, какие аминокислоты должны следовать друг за другом. Структурную перестройку в этом гене, приводящую к замене информации, называют мутацией. (Позже мы узнаем, что некоторые мутации затрагивают синтез белка или контроль над ним.)
Нарушение связи между геном и белком иллюстрирует такое наследственное заболевание, как сер-повидноклеточная анемия. Почти половина объема крови у нормального человека состоит из округлых, дискообразных красных кровяных клеток — эритроцитов, которые содержат гемоглобин, придающих им цвет. Гемоглобин переносит кислород, необходимый для нормального метаболизма клеток; красные кровяные тельца проникают по тонким капиллярам в самые удаленные уголки тканей и доставляют им кислород. Преобладает тип гемоглобина А (Нb А), который состоит из четырех полипептидных цепей: двух цепей альфа (по 141 аминокислоте в каждой) и двух цепей бета (по 146 аминокислот) (рис. 6.3). Это так называемые глобиновые части молекулы; каждая из них переносит небелковую группу гем — большую кольцевидную молекулу с атомом железа посередине. Именно благодаря атому железа эта часть присоединяет кислород. Отсюда понятна необходимость железа в составе нашей пищи.
Серповидноклеточная анемия характеризуется ненормальным строением гемоглобина, Hb S, который кодируется мутантным аллелем HbS. Kpacные кровяные тельца с ненормальным гемоглобином имеют необычную форму, и некоторые из них похожи на серп (рис. 6.4).
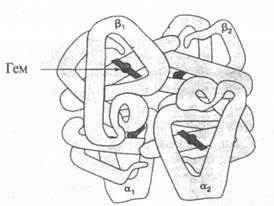
Рис. 6.3. Трехмерная структура гемоглобина. Каждая молекула состоит из четырех полипептидных цепей — двух альфа-цепей и двух бета-цепей. Эти цепи, комплементарные друг другу, образуют четвертичную структуру белка. В каждой цепи имеется по большому гему с атомом железа в центре; именно к нему присоединяется кислород
Такие кровяные клетки с трудом передвигаются по сосудам и иногда закупоривают их, вызывая сильную боль, повреждения органов и тканей, а в некоторых случаях даже служат причиной смерти. Анемия возникает в результате того, что серповидные клетки разрушаются обычно в три раза быстрее нормальных. У гетерози-гот HbAHbS проявляются некоторые черты этого заболевания, но клеток с гемоглобином НbА у них достаточно для нормального функционирования, поэтому они, как правило, здоровы. Анемия возникает только в 1 % случаев. Серповидноклеточная анемия широко распространена в Африке и других регионах, где распространена малярия. Поскольку лица, в крови которых присутствует гемоглобин Hb S, более устойчивы к малярии, то у гетерозигот имеется некоторое преимущество, и эти черты закрепились в некоторых популяциях (в других странах серповидноклеточная анемия чаще наблюдается также среди выходцев из Африки).
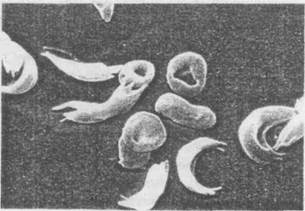
Рис. 6.4. Электронная микрофотография красных кровяных клеток человека, больного серповидноклеточной анемией. Ясно видна необычная форма этих клеток, отличающихся от нормальных — округлых. Публикуется с разрешения фотобиблиотеки Omikron/'Science
В J956 году Верной Инграм доказал, что гемо-глобины НbА и HbS различаются только по одной аминокислоте в бета-цепи (шестая от аминного конца). Обычно это глутаминовая кислота, но в HbS она заменена на валин:
Hb A: Val-His-Leu-Thr-Pro-G/u-Glu-Lys;
Hb S: Val-His-Leu-Thr-Pro-Va/-Glu-Lys.
Таким образом, во всей последовательности 146 аминокислот замена всего лишь одной из них приводит к опасному заболеванию.
В дальнейшем была определена последовательность обеих полипептидных цепей гемоглобина и обнаружены другие возможные нарушения (рис. 6.5). В каждом случае дефектный аллель приводит к образованию гемоглобина, идентичного нормальному за исключением одной аминокислоты или (иногда) короткой последовательности аминокислот. Соответствие «одна мутация — одна аминокислота» подтверждает мысль о том, что каждый отдельный ген определяет последовательность отдельного белка и что ген состоит из единиц, кодирующих отдельные аминокислоты, причем мутации может подвергаться каждая единица. Обычно мутация затрагивает одну аминокислоту, и образующийся белок лишь слегка отличается от нормального по форме и функциям.

Рис. 6.5. Последовательность первых 28 аминокислот нормальной бета-цепи гемоглобина человека с указанием возможных замен аминокислот в результате мутации. Одни мутации обозначаются буквами, другие — названиями мест, где были обнаружены страдающие этими наследственными нарушениями. Одна из мутаций представляет собой отсутствие аминокислоты
Другие мутации стирают одну или несколько аминокислот, а некоторые изменяют по следовательность аминокислот или добавляют новый фрагмент к обычному белку.
 2015-06-28
2015-06-28 1104
1104
