ВИЗНАЧЕННЯ ВІДНОШЕННЯ ТЕПЛОЄМНОСТІ ГАЗА ПРИ ПОСТІЙНОМУ ТИСКУ
ДО ЙОГО ТЕПЛОЄМНОСТІ ПРИ ПОСТІЙНОМУ ОБ'ЄМІ
Мета роботи: знайти відношення теплоємності при постійному тиску Сp до теплоємності при постійному об'ємі Сv для повітря, тобто показник ступеня в рівнянні Пуассона, що описує адіабатичний процес у газах.
Устаткування:
- скляний балон з насосом і манометром.
Теоретична підготовка: вивчить за підручниками [1-6] або за конспектом лекцій теми «Молекулярно-кінетична теорія», «Перший початок термодинаміки», «Рівняння адіабати ідеального газу», зверніть увагу на поняття теплоємності, молярної теплоємності, рівняння термодинамічних процесів.
СУТНІСТЬ ЛАБОРАТОРНОЇ РОБОТИ
І МЕТОДИКА ЕКСПЕРИМЕНТУ
Опис лабораторної установки
Для визначення показника адіабати застосовується метод Клемана - Дезорма, суть якого в наступному.
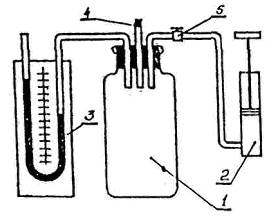
Мал. 4.16
Скляний балон 1 з U - подібним рідинним моностатиком 3 (мал. 4.16) за допомогою насоса 2 в балон нагнітають повітря до різниць рівнів рідини в манометрі порядку 15-20 см. Після чого кран 5 закривають. Оскільки при нагнітанні повітря в балон зовнішні сили виконують над газом роботу, газ нагрівається. Тому температура газу у балоні буде після припинення накачування вище кімнатної. Через деякий час температура в балоні вирівняється з кімнатною й різниця рівнів рідини в U - подібному моностатику зменшиться, залишаючись далі незмінною. Нехай різниця рівнів стане h1, тоді тиск у балоні
Р1 = Рат + h1,
де Рат - атмосферний тиск.
Відомо, що всі газові рівняння, у тому числі й рівняння Пуассона, що описують адіабатичний процес, справедливі для постійної (незмінної) маси газу. Якщо ж у ході процесу маса змінюється, тоді в рівнянні, що описує процес, використовують питомий об'єм газу (тобто об'єм одиниці маси речовини).
Нехай при тиску Р1, питомий об'єм повітря дорівнює V1. Якщо тепер на короткий час відкрити кран 4 в атмосферу й дати можливість частині повітря вийти з балона, то тиск у балоні понизиться до атмосферного. Питомий об'єм повітря в ньому стане рівним V2. Оскільки маса повітря в балоні зменшилася, а об'єм його не змінився, то V2 > V1
При розширенні повітря виконало роботу проти зовнішнього тиску. І оскільки розширення відбувалося дуже швидко, можна вважати, що за цей проміжок часу через стінки посудини не відбулося скільки-небудь істотного теплового обміну між газом і навколишнім середовищем, а процес розширення повітря в цьому досліді відбувається адіабатично. У підсумку можна стверджувати, що робота розширення відбувається за рахунок внутрішньої енергії повітря, яке міститься в балоні. Отже, його температура відразу ж після розширення повинна понизитися й стати нижче кімнатної.
У замкненому балоні повітря почне нагріватися до кімнатної температури, а тиск перевищить атмосферний. Це розсуне рівні рідини в U - подібному манометрі на h2, але питомий об'єм газу буде залишатися рівним V2.
Опишемо всі три стани газу в балоні параметрами стану.
Перший стан - до випускання повітря з балона: питомий об'єм V1;тиск Р1 = Pат + h1; температура Т0 (кімнатна).
Другий стан - відразу ж після виходу повітря з балона: питомий об'єм V1; тиск Рат; температура Т (нижча Т0).
Третій стан - після стабілізації температури: питомий об'єм той же – V2; тиск Р2 = Pат + h2 ', температура Т0 (кімнатна).
Перехід з першого стану в другий відбувається адіабатно, тобто
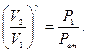
Для переходу з першого стану в третій, що відбувається при постійній температурі, справедливе рівняння ізотермічного процесу (закон Бойля - Маріотта):
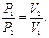
Об'єднаємо (7.10) і (7.11). Одержимо
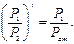
Знайдемо натуральний логарифм:
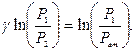
Звідки
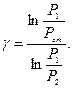
Замінимо Р1 і Р2 відповідно до станів:
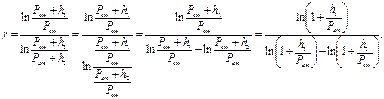 (*)
(*)
Відношення 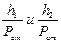 є величинами дуже малими, тому що знаменник значно більше чисельника. Відомо, що якщо х << 1, то ln(x +1)=х. Тоді (*) можна записати в наступному вигляді:
є величинами дуже малими, тому що знаменник значно більше чисельника. Відомо, що якщо х << 1, то ln(x +1)=х. Тоді (*) можна записати в наступному вигляді:
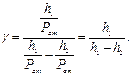 (4.31)
(4.31)
Використовуючи (4.31), можна визначити 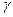 для досліджуваного газу.
для досліджуваного газу.
 2015-06-28
2015-06-28 623
623







