Окисление аммиака идет по уравнению 4NH3 + 5O2 D 4NO + 6H2O.
Через некоторое время концентрации веществ стали равными (моль/л):
[NH3]t = 0,009; [O2]t = 0,002; [NO]t =0,003.
Вычислите концентрацию водяного пара в этот момент и исходные концентрации аммиака и кислорода.
Решение.
До начала реакции концентрации продуктов равны нулю, а через некоторое время концентрация [NO] стала равной 0,003 моль/л, т. е.
[NO]t = D[NO] = 0,003.
Изменение концентрации компонентов реакции происходит в строгом соответствии со стехиометрическим соотношениями, т. е. коэффициентами уравнения. Тогда
[H2O]t = D[H2O],
D[H2O]: D[NO] = 6: 4,
D[H2O]: 0,003 = 6: 4,
D[H2O] = (6 × 0,003): 4 = 0,0045 моль/л,
D[H2O] = [H2O]t = 0,0045 моль/л.
Чтобы найти исходные концентрации аммиака и кислорода, необходимо рассчитать их убыль в ходе реакции и сложить с конечной концентрацией [NH4]t и [O2]t:
D[NH3]: D[NO] = 4: 4,
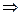 D[NH3] = (0,003 × 4): 4 = 0,003 моль/л;
D[NH3] = (0,003 × 4): 4 = 0,003 моль/л;
D[NH3]: 0,003 = 4: 4,
D[H2O]: D[O2] = 6: 5,
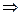 D[O2] = (0,0045 × 5): 6 = 0,00375 моль/л,
D[O2] = (0,0045 × 5): 6 = 0,00375 моль/л,
0,0045: D[O2] = 6: 5.
Отсюда
[NH3]исх. = [NH3]t + D[NH3] = 0,009 + 0,003 = 0,012 моль/л,
[O2]исх. = [O2]t + D[O2] = 0,02 + 0,00375 = 0,0238 моль/л.
 2015-06-24
2015-06-24 3114
3114








