Рассчитать ЭДС концентрационного гальванического элемента, в котором один медный электрод находится в 0,0001-молярном растворе соли меди, другой такой же электрод в 0,01-молярном растворе соли.
Решение.
Если медные электроды опущены в раствор сульфата меди разной концентрации, то, поскольку значение электродного потенциала металла зависит от концентрации раствора соли, возникает разность потенциалов и появляется электродвижущая сила. Такой гальванический элемент работает за счет выравнивания концентрации соли и называется концентрационным.
Чтобы рассчитать ЭДС элемента, найдем значения электродных потенциалов меди в растворах разной концентрации:
ECu = E0Cu + 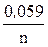 lg [Cu2+ × mH2O],
lg [Cu2+ × mH2O],
E1Cu = 0,34 + 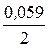 lg 0,0001 = 0,34 - 0,118 = 0,222 В,
lg 0,0001 = 0,34 - 0,118 = 0,222 В,
E2Cu = 0,34 + 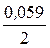 lg 0,01 = 0,34 - 0,059 = 0,281 В,
lg 0,01 = 0,34 - 0,059 = 0,281 В,
E1Cu < E2Cu.
Медный электрод в 0,0001-молярном растворе соли будет анодом и на нем идет процесс окисления, а в 0,01-молярном растворе – катодом, на нем идет процесс восстановления:
на аноде (-) Cu0 – 2 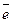 = Cu2+ – окисление,
= Cu2+ – окисление,
на катоде (+) Cu2+ + 2 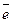 = Cu0 – восстановление.
= Cu0 – восстановление.
ЭДС = EК - EА = E2Cu - E1Cu = 0,281 - 0,222 = 0,059 В.
Задания
241. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
242. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами a) CuSO4; б) MgSO4 в) Pb(NO3)2. Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
243. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала. Ответ: 0,30 моль/л.
244. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии её с растворами: a) AgNО3; б) ZnSO4; в) NiSO4. Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
245. Марганцевый электрод в растворе его соли имеет потенциал –1,23 В. Вычислите концентрацию ионов Мn2+ в моль/л. Ответ: 1,89×10–2 моль/л.
246. Потенциал серебряного электрода в растворе AgNO3 составил 95 % от величины его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ в моль/л. Ответ: 0,20 моль/л.
247. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Со(NO3)2. В каком соотношении должна быть концентрация ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми?
Ответ: [Ni2+]: [Co2+]» 0,117.
248. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
249. При какой концентрации ионов Сu2+ в моль/л значение потенциала медного электрода становится равным стандартному потенциалу водородного элемента? Ответ: 1,89×10–12 моль/л.
250. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, состоящего из серебряных электродов, опущенных первый в 0,01 н., а второй – в 0,1н. растворы AgNO3. Ответ: 0,058 В.
251. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля. Ответ: 0,029 В.
252. Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией
[Pb2+] = [Mg2+] = 0,0l моль/л. Изменится ли э.д.с. этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
253. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
254. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
255. Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией
[Мg2+] = [Cd2+] = 1 моль/л. Изменится ли величина э.д.с., если концентрацию каждого из ионов понизить до 0,01 моль/л. Ответ: 1,967 В.
256. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ноны железа (в моль/л), чтобы э.д.с. элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3×10–15 моль/л.
257. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb (NO3)2 = Ni (NO3)2 + Pb.
Напишите электронные уравнения анодного и катодного процессов. Вычислите э.д.с. этого элемента, если [Ni2+] = 0,01 моль/л, [Pb2+] = 0,0001моль/л. Ответ: 0.066 В.
258. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
259. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
260. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
Электролиз
 2015-06-24
2015-06-24 4507
4507
