Электрическая работа, получаемая с помощью гальванического элемента, будет максимальной, когда элемент работает в условиях, наиболее близких к обратимым. Максимальная разность потенциалов электродов данного гальванического элемента, которая определяется в условиях равновесия, называется его электродвижущей силой (ЭДС). Она равна разности равновесных потенциалов катода и анода элемента.
При стандартных условиях:
ЭДС0 = Dj0 = j0катода -j0анода. (7.3)
Пример 10. Вычислить ЭДС гальванического элемента, составленного из магниевого и свинцового электродов, в котором [Mg2+] = 0,1 M; [Pb2+] = 0,001 M.
Решение. j0 Mg2+/Mg = -2,37 В; j0 Pb2+/Pb = -0,13 B (табл. 7.1); j 0 магниевого электрода меньше, т.е. Mg является более активным металлом, поэтому в гальваническом элементе магний будет анодом, а свинец - катодом.
На электродах будут протекать следующие процессы:
А: Mg - 2e = Mg2+,
К: Pb2+ + 2e = Pb0.
Схема гальванического элемента записывается так: Mg½Mg2+?Pb2+½Pb.
Для расчета ЭДС необходимо найти электродные потенциалы.
Согласно уравнению (7.2):
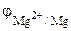 = j0 +
= j0 + 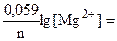 -2,37 + 0,0295.lg 0,1 = -2,4 B;
-2,37 + 0,0295.lg 0,1 = -2,4 B;
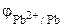 = -0,13 + 0,0295.lg 0,001 = -0,13 + 0,0295·(-3) = -0,22 В.
= -0,13 + 0,0295.lg 0,001 = -0,13 + 0,0295·(-3) = -0,22 В.
ЭДС = j кат - j ан = -0,25 - (-2,4) = 2,15 В.
Пример 11. Определить ЭДС гальванического элемента, составленного из серебряных электродов, опущенных в 0,0001 М и 0,1 М растворы AgNO3.
Решение. Гальванический элемент может быть составлен не только из различных, но и одинаковых электродов, погруженных в растворы одного и того же электролита различной концентрации (концентрационные элементы). Найдем электродные потенциалы по формуле Нернста (7.2):
j 1Ag+ / Ag = j0 + 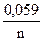 ×lg[Ag+] = 0,8 + 0,059 × lg0,001 = 0,8 + 0,059×(-3) = 0,62 В,
×lg[Ag+] = 0,8 + 0,059 × lg0,001 = 0,8 + 0,059×(-3) = 0,62 В,
j 2 Ag+ / Ag = 0,8 + 0,059×lg0,1 = 0,8 - 0,059 = 0,74 В.
Поскольку j1 < j2, электрод, опущенный в 0,001 М раствор, будет являться анодом:
ЭДС = j кат - j ан = 0,74 - 0,62 = 0,12 В.
Схема такого гальванического элемента записывается так:
(-) Ag½ AgNO3(0,001М)? AgNO3(0,1М) ½ Ag(+).
Как уже было показано на примере водородного электрода, электроды, а следовательно, и гальванические элементы могут быть созданы не только для реакции окисления-восстановления металлов, но и для любых веществ и окислительно-восстановительных реакций, происходящих в растворах или расплавах.
Например, для реакции в растворе:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
процессы окисления и восстановления можно разделить в виде полуреакций:
на аноде: 5 ½ SO32- + H20 = SO42- + 2H+ + 2?; (0,17 В),
на катоде: 2 ½ MnO4- + 8H+ + 5e = Mn2+ + 4H2O (1,51 В).
Суммируем:
2MnO4- + 5SO32- + 6H+ + 10? = 2Mn2+ + 5SO42- + 3H2O + 10?.
Т окообразующая реакция:
2MnO4- + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O.
Для осуществления таких реакций обычно используют катализатор, который одновременно является проводником электронов, например платину (рис. 7.3).
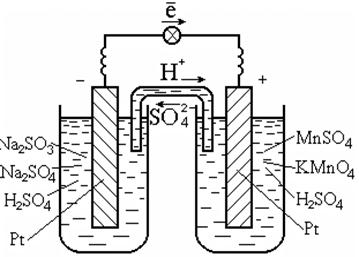
Рис. 7.3. Гальванический элемент на окислительно-восстановительной реакции в растворе
Схема гальванического элемента:
Pt | SO32-, SO42-, H+|| MnO4-, Mn2+, H+| Pt.
Значения стандартных электродных потенциалов полуреакций приводятся в справочниках.
ЭДС такого элемента при стандартных условиях можно определить как разность потенциалов для полуреакций восстановления (окислителя) и окисления (восстановителя).
ЭДС = Dj0 = j0 (MnО4-/ Mn2+) - j0 (SO42- / SO32-) = 1,51 - 0,17 = 1,34 B.
Если при этом ЭДС положительна, то реакция возможна при стандартных условиях, так как DG реакции и электрическая работа (ЭДС) связаны между собой соотношением:
DG = -n×F×Dj,
где F - постоянная Фарадея (заряд, переносимый одним молем элементарных зарядов (F = 96485, или»96500Кул/моль экв);
n - заряд, переносимый одной частицей (для Zn2+ и Cu2+ n = 2);
Dj = jкатода - jанода = jок-ля - jвосст-ля.
Таким образом, разность потенциалов на электродах можно не только непосредственно измерить, но и вычислить из чисто химических экспериментальных данных. В случае нестандартных условий потенциал электрода и ЭДС элемента рассчитывается по формуле Нернста (7.1).
Например, для рассматриваемой реакции:
 ,
,
(n = 10). Так как концентрации реагентов находятся под знаком логарифма, то зависимость Dj от них слабая.
 2014-02-02
2014-02-02 36925
36925
