Тема1. Общие сведения о белках. (4 часа).
Вопрос 1. Элементарный состав белков.
Вопрос 2. Полипептидная теория химического строения белков.
Вопрос 3. Пространственное строение белков. Типы химических связей в белках.
Вопрос 4. Классификация белков.
Вопрос 5. Биосинтез белков и его регуляция.
Вопрос 1. Белки, или протеины (от греч. protos – первый, важнейший), являются важнейшим классом органических соединений, играющим основополагающую роль в жизнедеятельности любой живой клетки. На долю белков приходится не менее 50 % сухой массы органических веществ клетки. Учитывая разнообразие живых организмов можно судить о существовании нескольких миллиардов химически индивидуальных белков, отличающихся как структурой, так и функциями. Например, клетка кишечной палочки содержит 3000 различных белков, а человеческий организм ~1млн.
Средний элементарный состав большинства белков (%): углерод – 50-54; кислород – 20-23; азот – 15-18; водород – 6-8; сера 0,3-2,5. Однако в мире белков существуют исключения, например в белках – протаминах содержание азота достигает 30 %.
Роль структурных элементов в белках выполняют L-изомеры α-аминокислот, отличающиеся друг от друга боковыми радикалами. Именно их специфические особенности придают каждому белку индивидуальность и влияют на его биологические и физико-химические свойства.
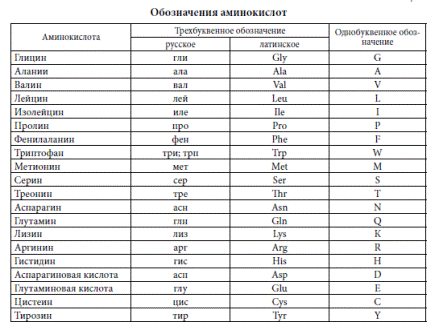
В настоящее время приняты три основных типа классификации аминокислот:
- Структурная — по строению бокового радикала;
- Биологическая или физиологическая — по степени незаменимости амино-
кислот для организма;
- Электрохимическая — по кислотно-основным свойствам аминокислот.
Для удобства записи структуры белков и пептидов предложены три основных способа сокращенного обозначения протеиногенных аминокислот:
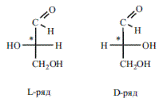
Оптическая изомерия аминокислот. Все протеиногенные аминокислоты кроме глицина — оптически активны и имеют как минимум один хиральный центр и принадлежат, как уже упоминалось к L-ряду. Интересно отметить, что L-аминокислоты имеют сладкий вкус, a D-изомеры без- вкусны или горькие.
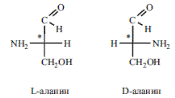
Принадлежность аминокислот к L- или D-ряду определяется по расположению функциональных групп у хирального атома углерода, несущего аминогруппу, в срав- нении с глицериновым альдегидом.
Однако ряд протеиногенных аминокислот имеет несколько хиральных центров и несколько оптических изомеров может принадлежать к L-ряду. Так, например, треонин имеет два хиральных центра (n = 2) и соответственно 2n = 22 = 4 оптических изомера. Из этих двух оптических изомеров именно L-треонин входит в состав природных белков:
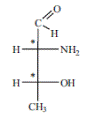
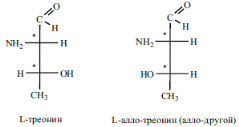
Еще два оптических изомера треонина относятся к D-ряду и в составе белков не обнаруживаются.
 2015-06-24
2015-06-24 795
795







