При выводе уравнений теплового баланса принято, что основными определяющими процессами для теплового состояния системы являются: физическое тепло входных и выходных потоков, химические реакции с соответствующими тепловыми эффектами и теплообмен с окружающей средой. Уравнения теплового баланса базируются на законе сохранения энергии Qприх=Qрасх.
С учетом теплосодержания входных - выходных потоков, общего тепла химических реакций, протекающих в системе, тепла от внешних источников, а также потерь в окружающую среду уравнение теплового баланса имеет вид:
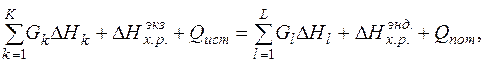 (1)
(1)
где 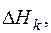
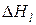 -энтальпия единицы массы k -го входного и l -го выходного потоков относительно температуры 298 К, кДж/кг; К, L - общее количество входных и выходных потоков; Gk, Gl – массы входных и выходных потоков соответственно, кг; Qист, - приход тепла в систему от внешних источников, кДж; Qпот - тепловые потери в окружающую среду, кДж;
-энтальпия единицы массы k -го входного и l -го выходного потоков относительно температуры 298 К, кДж/кг; К, L - общее количество входных и выходных потоков; Gk, Gl – массы входных и выходных потоков соответственно, кг; Qист, - приход тепла в систему от внешних источников, кДж; Qпот - тепловые потери в окружающую среду, кДж; 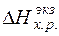 ,
, 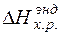 - тепловой эффект экзотермических и эндотермических химических реакций, кДж.
- тепловой эффект экзотермических и эндотермических химических реакций, кДж.
Основными статьями приходной части теплового баланса являются тепло жидкого чугуна, тепло экзотермических реакций окисления компонентов шихты газообразным кислородом, тепло реакций шлакообразования и тепло внешних источников тепла.
К расходной части теплового баланса относятся затраты тепла на нагрев металла, шлака, газа, на разложение карбонатов, оксидов железа, испарение влаги и тепловые потери в окружающую среду.
Энтальпия единицы массы жидкого чугуна относительно T= 298 K определяется следующим образом:
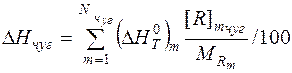 , (2)
, (2)
где 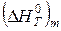 - изменение энтальпии 1 моля m- го вещества жидкого чугуна при нагреве от 298 К до Tk, кДж/моль; Rmчуг - концентрация вещества Rm в чугуне, %; MRm - молярная масса вещества Rm, кг/моль; Nчуг – количество веществ в чугуне.
- изменение энтальпии 1 моля m- го вещества жидкого чугуна при нагреве от 298 К до Tk, кДж/моль; Rmчуг - концентрация вещества Rm в чугуне, %; MRm - молярная масса вещества Rm, кг/моль; Nчуг – количество веществ в чугуне.
Тепловой эффект экзотермических реакций определяется суммой тепловых эффектов реакций окисления железа, углерода, примесей и горения метана.
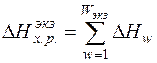 , (3)
, (3)
где Wэкз – число экзотермических реакций; DHw - тепловой эффект w -ой химической реакции, кДж.
Тепловой эффект w -ой химической реакции рассчитываем по формуле:
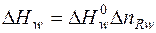 , (4)
, (4)
где 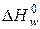 - стандартный тепловой эффект w- ой химической реакции;
- стандартный тепловой эффект w- ой химической реакции; 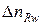 - количество молей вещества R, прореагировавшего в w -ой реакции.
- количество молей вещества R, прореагировавшего в w -ой реакции.
Число молей участвовавшего в реакции вещества Rw определяется разностью его содержания во входных - выходных потоках:
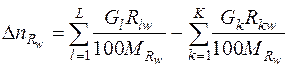 . (5)
. (5)
Таким образом, тепловой эффект экзотермических реакций равен:
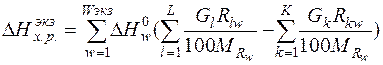 (6)
(6)
К экзотермическим реакциям относятся также реакции шлакообразования, тепловой эффект реакций шлакообразования рассчитывается по формуле:
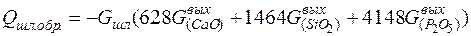 , (7)
, (7)
где 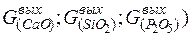 - количество соответствующих оксидов в шлаке, кг.
- количество соответствующих оксидов в шлаке, кг.
Энтальпию единицы массы металла, шлака и газа рассчитываем аналогично энтальпии единицы массы чугуна:
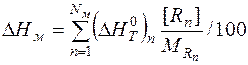
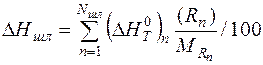 (8)
(8)
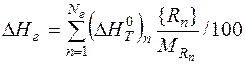 ,
,
где 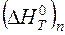 - изменение энтальпии 1 моля n- го вещества при нагреве от 298 К до Tk, кДж/моль; [ Rn ], (Rn), { Rn }, - концентрация вещества Rn в металле, шлаке и газе соответственно, %; MRn - молярная масса вещества Rn, кг/моль; Nм, Nшл, Nг – количество веществ в металле, шлаке и газе.
- изменение энтальпии 1 моля n- го вещества при нагреве от 298 К до Tk, кДж/моль; [ Rn ], (Rn), { Rn }, - концентрация вещества Rn в металле, шлаке и газе соответственно, %; MRn - молярная масса вещества Rn, кг/моль; Nм, Nшл, Nг – количество веществ в металле, шлаке и газе.
К эндотермическим реакциям относятся реакции разложения оксидов железа, разложения карбонатов и испарения влаги, суммарный тепловой эффект эндотермических реакций рассчитаем по формуле:
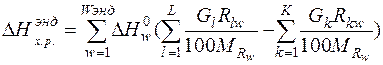 (9)
(9)
С учетом вышеизложенного уравнение теплового баланса имеет вид:
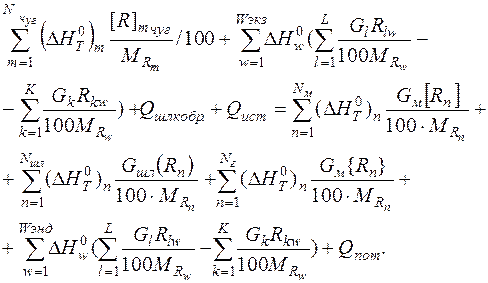 (10)
(10)
В таблице 1 представлен расчет теплового баланса по статьям.
Таблица 1 – Расчет теплового баланса по статьям
| Статья | Тепловой эффект |
| Приходная часть | |
| Физическое тепло чугуна | 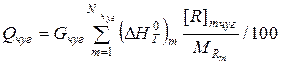 |
| Тепло экзотермических реакций | 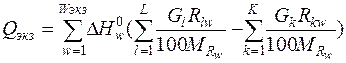 |
| Тепло шлакообразования | 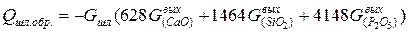 |
| Тепло внешних ист-ков | 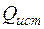 |
| Расходная часть | |
| Тепло металла | 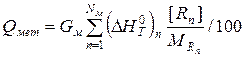 |
| Тепло шлака | 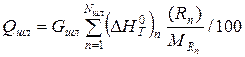 |
| Тепло газа | 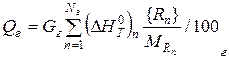 |
| Тепло эндотермических реакций | 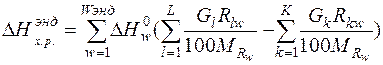 |
| Тепловые потери | Qпот |
2. Пример расчета ТЕПЛОВОГО баланса
Для расчета теплового баланса воспользуемся результатами расчетов материального баланса.
Приходная часть теплового баланса включает в себя энтальпию нагретых входных потоков, тепловой эффект экзотермических реакций и тепло от внешних источников тепла (1). Энтальпию, отличную от нуля имеет только жидкий чугун, так как его температура выше T = 298 K и равна 1400 º С или 1673 К (см. Методические указания «Расчет материального баланса металлургического процесса», табл. 1)
Энтальпию жидкого чугуна рассчитываем по формуле (2) как сумму энтальпий составляющих компонентов.
Расчет энтальпии вещества с учетом фазовых переходов осуществляется по формуле:
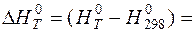
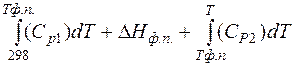 , (11)
, (11)
где СР1, СР2 – теплоемкость вещества до и после фазового перехода, кДж/моль; 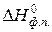 - энтальпия фазового перехода, кДж/моль.
- энтальпия фазового перехода, кДж/моль.
Уравнение для расчета теплоемкости вещества имеет вид:
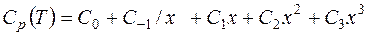 , Дж/моль. (12)
, Дж/моль. (12)
где  x=Т/ 10000 К - приведенная температура;
x=Т/ 10000 К - приведенная температура; 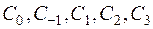 - коэффициенты аппроксимационного уравнения для теплоемкости вещества.
- коэффициенты аппроксимационного уравнения для теплоемкости вещества.
С учетом перехода к температуре Т уравнение для теплоемкости примет вид:
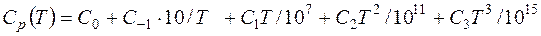 , (13)
, (13)
или иначе
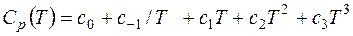 , (14)
, (14)
где
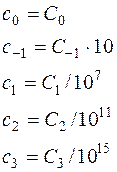
С использованием формулы (14), получаем новое уравнение для расчета теплоемкости:
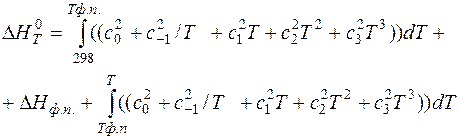 (15)
(15)
После интегрирования получаем:
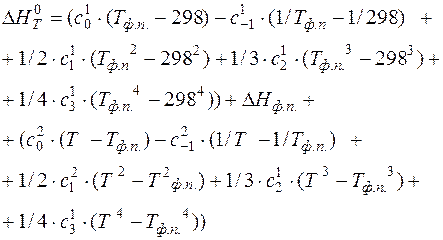 (16)
(16)
В случае, когда в заданном температурном интервале вещество претерпевает несколько фазовых переходов, в расчетной формуле следует учесть все эти изменения.
Исходные данные для расчета энтальпии вещества (коэффициенты для теплоемкости Сi и изменения энтальпии фазовых переходов ∆ H ф.п.) представлены в Приложении 1.
Рассчитаем энтальпию 1 моля железа, как составляющего компонента чугуна, температура которого составляет 1673 К.
Используя формулу (16), получаем
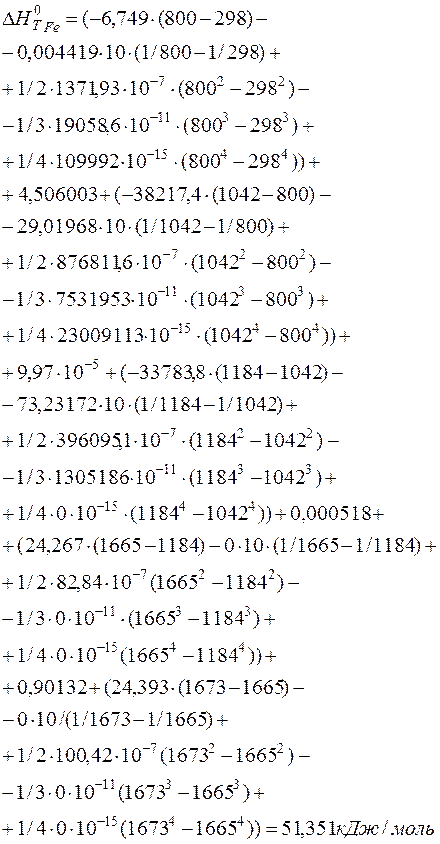 (17)
(17)
Или 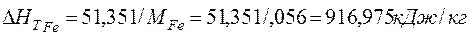
Таким же образом рассчитываем удельные энтальпии всех остальных составляющих чугуна – C, Mn, Si, S, P. Результаты расчетов представлены в таблице 2. В первой строчке таблицы приведен химический состав чугуна (см. методические указания «Расчет материального баланса металлургического процесса», табл. 4); во второй – молярные массы компонентов; в третьей и четвертой – представлены рассчитанные по формуле (16) значения удельных энтальпий составляющих чугуна, кДж/моль и кДж/кг; в последней строчке рассчитаны полные энтальпии всех компонентов чугуна с учетом их содержания в чугуне.
Таблица 2 - Расчет энтальпии чугуна.
| Чугун | Fe | С | Mn | Si | S | P |
| % | 94,41% | 4,70% | 0,34% | 0,44% | 0,02% | 0,09% |
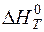 , кДж/моль , кДж/моль | 51,35 | 27,54 | 62,84 | 35,86 | 30,19 | 28,21 |
| М, кг/моль | 0,056 | 0,012 | 0,055 | 0,028 | 0,032 | 0,031 |
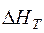 , кДж/кг , кДж/кг | 916,98 | 2295,35 | 1142,53 | 1280,83 | 943,40 | 910,00 |
| ∆ НТ, кДж | 865,71 | 107,88 | 3,88 | 5,64 | 0,20 | 0,82 |
Энтальпию 1 кг чугуна рассчитываем как сумму энтальпий всех его составляющих:
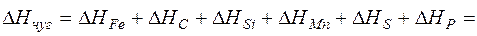
=865,71+107,88+5,64+3,88+0,2+0,82=984,13 кДж/кг. (18)
Тогда теплосодержание чугуна соответственно равно
Qчуг = 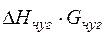 =984,13∙30=29523,78 кДж. (19)
=984,13∙30=29523,78 кДж. (19)
Для расчета энтальпии конечных продуктов – металла, шлака, газа – следует задать их температуру. Параметры процесса, необходимые для расчета теплового баланса, представлены в таблице 3.
Таблица 3 – Задание параметров процесса
| Температура металла, С | |
| Температура шлака, С | |
| Температура газа, С | |
| Тепловые потери в печи, кДж | |
| Тепло внешних источников, кДж |
Для расчета также необходимы данные по химическому составу и массам фаз (см. Методические указания «Расчет материального баланса металлургического процесса» табл. 7-9). Энтальпию металла, шлака и газа рассчитываем по формулам (8):
Результаты расчетов представлены в таблицах 4-6.
Таблица 4 – Расчет энтальпии компонентов металлической фазы
| Металл | Fe | С | Mn | Si | S | P | Ti |
| % | 99,224% | 0,512% | 0,204% | 0,011% | 0,018% | 0,025% | 0,001% |
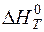 , кДж/моль , кДж/моль | 66,238 | 32,492 | 72,439 | 91,492 | 34,437 | 32,394 | 54,817 |
| М, кг/моль | 0,056 | 0,012 | 0,055 | 0,028 | 0,032 | 0,031 | 0,048 |
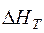 , кДж/кг , кДж/кг | 1182,82 | 2707,64 | 1317,07 | 3267,56 | 1076,16 | 1044,98 | 1142,01 |
| ∆ НТ, кДж | 1173,644 | 13,858 | 2,691 | 0,370 | 0,196 | 0,257 | 0,006 |
| Металл | V | Ni | Al | Mg | Ca | O | Cr |
| % | 0,001% | 0,003% | 0,000% | 0,000% | 0,000% | 0,001% | 0,001% |
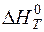 , кДж/моль , кДж/моль | 48,804 | 57,985 | 58,666 | 58,848 | 59,874 | 53,906 | 58,916 |
| М, кг/моль | 0,051 | 0,059 | 0,027 | 0,024 | 0,040 | 0,016 | 0,052 |
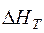 , кДж/кг , кДж/кг | 956,95 | 982,79 | 2172,82 | 2451,98 | 1496,84 | 3369,11 | 1133,01 |
| ∆ НТ, кДж | 0,007 | 0,028 | 0,000 | 0,000 | 0,000 | 0,026 | 0,009 |
Таблица 5 – Расчет энтальпии компонентов шлаковой фазы
| Шлак | FeO | Fe2O3 | CaO | MnO | SiO2 | Al2O3 | P2O5 |
| % | 21,53% | 7,85% | 48,85% | 2,63% | 10,97% | 3,75% | 0,06% |
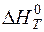 , кДж/моль , кДж/моль | 157,71 | 242,93 | 83,20 | 85,57 | 115,34 | 272,04 | 223,41 |
| М, кг/моль | 0,072 | 0,160 | 0,60 | 0,071 | 0,060 | 0,102 | 0,142 |
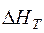 , кДж/кг , кДж/кг | 2190,45 | 1518,31 | 1485,77 | 1205,20 | 1922,28 | 2667,08 | 1573,34 |
| ∆ НТ, кДж | 471,55 | 119,25 | 725,75 | 31,74 | 210,85 | 99,98 | 0,91 |
| Шлак | MgO | CaF2 | CaS | TiO2 | V2O5 | Cr2O3 | NiO |
| % | 1,54% | 2,09% | 0,47% | 0,07% | 0,09% | 0,06% | 0,03% |
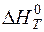 , кДж/моль , кДж/моль | 79,23 | 248,11 | 86,88 | 116,82 | 300,65 | 216,21 | 96,45 |
| М, кг/моль | 0,040 | 0,078 | 0,072 | 0,080 | 0,182 | 0,152 | 0,142 |
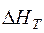 , кДж/кг , кДж/кг | 1980,77 | 3180,86 | 1206,69 | 1460,28 | 1651,92 | 1422,45 | 1286,05 |
| ∆ НТ, кДж | 30,581 | 66,434 | 5,702 | 1,06 | 1,56 | 0,81 | 0,44 |
Таблица 6 – Расчет энтальпии компонентов газовой фазы
| Газ | СО | СО2 | N2 | H2 | H2O | SO2 |
| % | 60,70% | 27,22% | 0,30% | 0,00% | 11,55% | 0,22% |
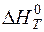 , кДж/моль , кДж/моль | 49,88 | 79,91 | 49,20 | 47,38 | 63,92 | 79,66 |
| М, кг/моль | 0,028 | 0,044 | 0,028 | 0,002 | 0,018 | 0,064 |
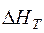 , кДж/кг , кДж/кг | 1781,36 | 1816,13 | 1757,29 | 23689,37 | 3551,10 | 1244,69 |
| ∆ НТ, кДж | 1081,28 | 494,42 | 5,30 | 0,00 | 410,32 | 2,75 |
Таким образом, удельная энтальпия металла равна
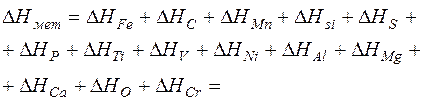
=1173,644 + 13,858 + 2,691 + 0,370 + 0,196 + (20)
+ 0,257 + 0,006 + 0,007 + 0,028 + 0,000 + 0,000 +
+ 0,000 + 0,026 + 0,009 = 1191,09 кДж/кг.
Теплосодержание металла определим с учетом его массы:
Qмет = 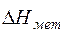 · Gмет =1191,09·123,601 =147220,48 кДж. (15)
· Gмет =1191,09·123,601 =147220,48 кДж. (15)
Удельная энтальпия шлака соответственно равна сумме энтальпий его составляющих:
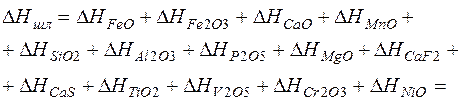
= 471,55 + 119,25 + 725,75 + 31,74 + 210,85 + 99,98 + (21)
+ 0,91 + 30,581 + 66,434 + 5,702 + 1,06 + 1,56 +
+ 0,81 + 0,44 = 1766,61 кДж/кг.
Полная энтальпия шлака:
Qшл = 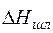 · Gшл = 1766,61·13,409 =23689,003 кДж. (22)
· Gшл = 1766,61·13,409 =23689,003 кДж. (22)
Определим удельную энтальпию газа:
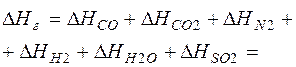
= 1081,28 + 494,42 + 5,30 + 0,00 + (23)
+ 410,32 + 2,75 =1994,06 кДж/кг,
и полную энтальпию газа:
Qг = 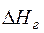 · Gг = 1994,07 ·5,107 =10183,24 кДж. (24)
· Gг = 1994,07 ·5,107 =10183,24 кДж. (24)
После расчета энтальпий входных - выходных потоков, необходимо рассчитать статьи теплового баланса, связанные с тепловым эффектом химических реакций.
Перечень независимых реакций процесса с соответствующими тепловыми эффектами представлен таблице 7.
Из таблицы следует, что основными экзотермическими реакциями являются реакции окисления железа (1,2), реакции окисления углерода (3,4), окисления прочих примесей (5-15), горение природного газа (16) и реакции шлакообразования (17). К эндотермическим реакциям относятся реакции разложения оксидов железа (18,19), испарения влаги (20) и разложения карбонатов (21). При расчете теплового баланса процесса принимаем, что оксиды железа в шлаке получены в результате окисления железа. Оксиды железа, присутствующие в шихтовых материалах полностью разлагаются.
В таблице 8 представлены стандартные тепловые эффекты химических реакций. Если изменение энтальпии в результате протекания химической реакции имеет отрицательное значение, то, следовательно, данная реакция экзотермическая. И в баланс тепловой эффект этой реакции следует включать в приход тепла с положительным знаком.
Таблица 7 – Перечень независимых реакций
| № | Реакция | Тепловой эффект |
| [Fe]+1/2{O2}=(FeO) | 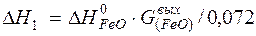 | |
| 2[Fe]+3/2{O2}=(Fe2O3) | 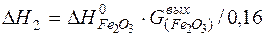 | |
| [С]+1/2{О2}={СО} | 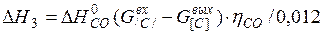 | |
| [С]+{О2} ={СО2} | 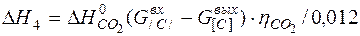 | |
| [Si]+{O2}=(SiO2) | 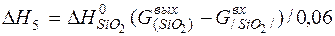 | |
| [Mn]+1/2{O2}=(MnO) | 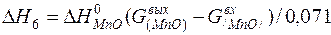 | |
| 2[Al]+3/2{O2}=(Al2O3) | 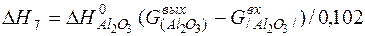 | |
| 2[P]+5/2{O2}=(P2O5) | 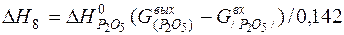 | |
| [S]+{O2}={SO2} | 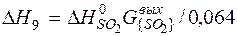 | |
| [Ti]+{O2}=(TiO2) | 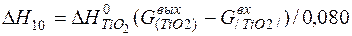 | |
| 2[V]+5/2{O2}=(V2O5) | 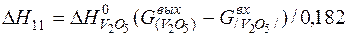 | |
| [Ni]+1/2{O2}=(NiO) | 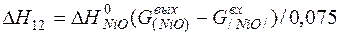 | |
| [Ca]+1/2{O2}=(CaO) | 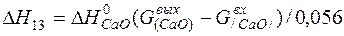 | |
| [Mg]+1/2{O2}=(MgO) | 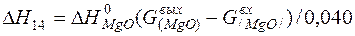 | |
| 2[Сr]+3/2{O2}=(Cr2O3) | 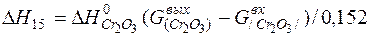 | |
| {CH4}+2{O2}={CO2}+2{H2O} | 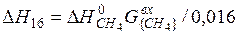 | |
| Шлакообразование | 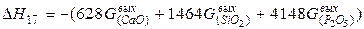 | |
| [Fe]+1/2{O2}=(FeO) | 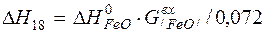 | |
| 2[Fe]+3/2{O2}=(Fe2O3) | 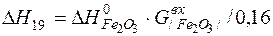 | |
| /H2O/={ H2O} | 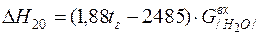 | |
| (CaCO3) = (CaO)+{CO2} | 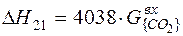 |
Таблица 8 – Стандартные тепловые эффекты реакций
| № | Реакция | Диапазон температур, К | Тепловой эффект реакции 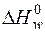 , кДж/моль , кДж/моль |
| [Fe]+1/2{O2}=(FeO) | 1809-3000 | -240,744 | |
| 2[Fe]+ 3/2{O2}= (Fe2O3) | 1809-3000 | -825,384 | |
| [С]+1/2{О2}={СО} | 1000-2000 | -114,954 | |
| [С]+{О2} ={СО2} | 1500-2000 | -397,971 | |
| [Si]+{O2}=(SiO2) | 1690-1996 | -952,699 | |
| [Mn]+1/2{O2}=(MnO) | 1517-2058 | -408,156 | |
| 2[Al]+3/2{O2}=(Al2O3) | 932-2303 | -1693,230 | |
| 2[P]+5/2{O2}=(P2O5) | 1000-2000 | -1586,970 | |
| [S]+{O2}={SO2} | 800-3001 | -358,260 | |
| [Ti]+{O2}=(TiO2) | 1000-1950 | -942,497 | |
| 2[V]+5/2{O2}=(V2O5) | 943-3000 | -1469,034 | |
| [Ni]+1/2{O2}=(NiO) | 1726-2263 | -254,730 | |
| [Ca]+1/2{O2}=(CaO) | 1765-2860 | -783,972 | |
| [Mg]+1/2{O2}=(MgO) | 1376-3098 | -730,380 | |
| 2[Сr]+3/2{O2}=(Cr2O3) | 1000-2171 | -1136,142 | |
| {CH4}+2{O2}={CO2}+2{H2O} | 298-3000 | -3345,132 | |
| [Fe]+1/2{O2}=(FeO) | 1650-1809 | 229,656 | |
| 2[Fe]+3/2{O2}=(Fe2O3) | 298-1809 | 816,942 |
В таблице 9 приведен расчет тепловых эффектов химических реакций. Отрицательные значения теплового эффекта реакций окисления примесей говорят о том, что при заданных коэффициентах распределения элементов по фазам (см. Методические указания «Расчет материального баланса металлургического процесса», табл. 3) проbсходит незначительное восстановление этих элементов.
Таким образом, имеются все данные для составления теплового баланса по статьям. Расчет представлен в таблице 10. Невязка теплового баланса, рассчитываемая как относительная разница между приходом и расходом тепла 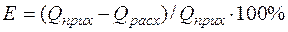 , составляет -0,029%.
, составляет -0,029%.
Таблица 9 – Расчет тепловых эффектов химических реакций
| № | Реакция | Расчет теплового эффекта | ∆ Н, кДж | Q, кДж |
| [Fe]+1/2{O2}=(FeO) | 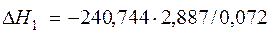 | -9652,14 | 9652,14 | |
| 2[Fe]+3/2{O2}=(Fe2O3) | 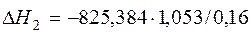 | -5433,03 | 5433,03 | |
| [С]+1/2{О2}={СО} | 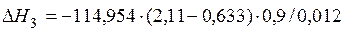 | -127226,18 | 127226,18 | |
| [С]+{О2} ={СО2} | 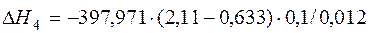 | -4835,44 | 4835,44 | |
| [Si]+{O2}=(SiO2) | 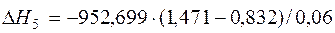 | -4235,44 | 4235,44 | |
| [Mn]+1/2{O2}=(MnO) | 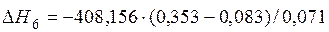 | -1554,40 | 1554,40 | |
| 2[Al]+3/2{O2}=(Al2O3) | 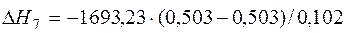 | 0,00 | 0,00 | |
| 2[P]+5/2{O2}=(P2O5) | 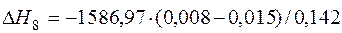 | +86,37 | -86,37 | |
| [S]+{O2}={SO2} | 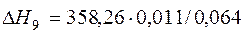 | -63,05 | 63,05 | |
| [Ti]+{O2}=(TiO2) | 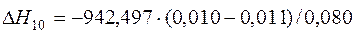 | +12,79 | -12,79 | |
| 2[V]+5/2{O2}=(V2O5) | 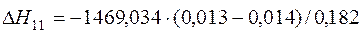 | +7,79 | -7,79 | |
| [Ni]+1/2{O2}=(NiO) | 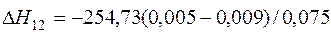 | +15,45 | -15,45 | |
| [Ca]+1/2{O2}=(CaO) | 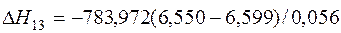 | +689,90 | -689,90 | |
| [Mg]+1/2{O2}=(MgO) | 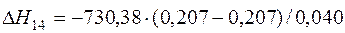 | 0,00 | 0,00 | |
| 2[Сr]+3/2{O2}=(Cr2O3) | 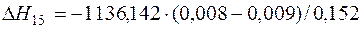 | +10,88 | -10,88 | |
| {CH4}+2{O2}={CO2}+2{H2O} | 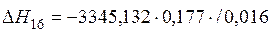 | -37026,43 | 37026,43 | |
| Шлакообразование | 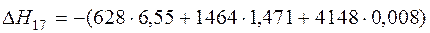 | -6299,02 | 6299,02 | |
| [Fe]+1/2{O2}=(FeO) | 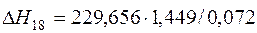 | +4622,40 | -4622,40 | |
| 2[Fe]+3/2{O2}=(Fe2O3) | 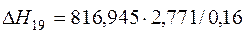 | +20417,62 | -20417,62 | |
| /H2O/={ H2O} | 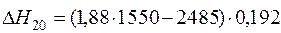 | +1052,46 | -1052,46 | |
| (CaCO3) = (CaO)+{CO2} | 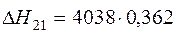 | +1461,76 | -1461,76 |
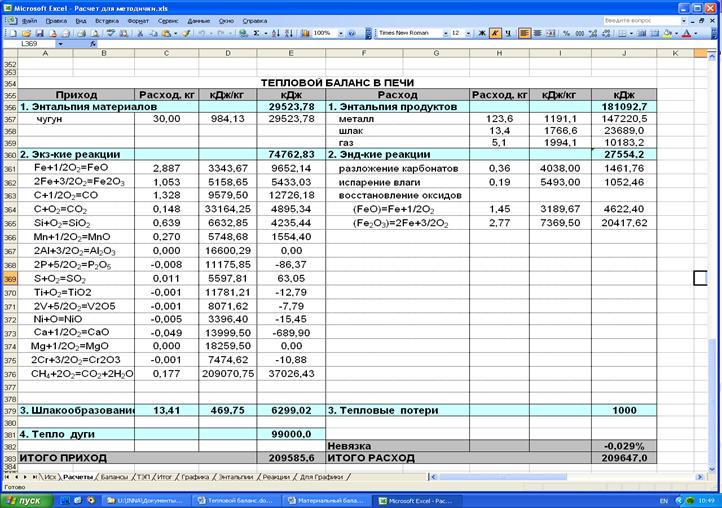
Таблица 10 – Тепловой баланс металлургического процесса
| Статья теплового баланса | Коли-чество, кг | Тепловой эффект, кДж/кг | Тепловой эффект, кДж | Статья теплового баланса | Коли-чество, кг | Тепловой эффект кДж/кг | Тепловой эффект, кДж |
| Приход тепла | Расход тепла | ||||||
| Энтальпия мат-в | 29523,78 | Энтальпия прод. | 181092,7 | ||||
| чугун | 30,00 | 984,13 | 29523,78 | металл | 123,6 | 1191,1 | 147220,5 |
| шлак | 13,4 | 1766,6 | 23689,0 | ||||
| газ | 5,1 | 1994,1 | 10183,2 | ||||
| Экзотермич. реакции | 74762,83 | Эндотермич. реакции | 27554,2 | ||||
| Fe+1/2O2=FeO | 2,887 | 3343,67 | 9652,14 | CaCO3= CaO+CO2 | 0,36 | 4038,00 | 1461,76 |
| 2Fe+3/2O2=Fe2O3 | 1,053 | 5158,65 | 5433,03 | /H2O/={ H2O} | 0,19 | 5493,00 | 1052,46 |
| C+1/2O2=CO | 1,328 | 9579,50 | 12726,18 | восстановление Fe | |||
| C+O2=CO2 | 0,148 | 33164,25 | 4895,34 | (FeO)=Fe+1/2O2 | 1,45 | 3189,67 | 4622,40 |
| Si+O2=SiO2 | 0,639 | 6632,85 | 4235,44 | (Fe2O3)=2Fe+3/2O2 | 2,77 | 7369,50 | 20417,62 |
| Mn+1/2O2=MnO | 0,270 | 5748,68 | 1554,40 | ||||
| 2Al+3/2O2=Al2O3 | 0,000 | 16600,29 | 0,00 | ||||
| 2Р+5/2О2=Р2О5 | -0,008 | 11175,85 | -86,37 | ||||
| S+O2=SO2 | 0,011 | 5597,81 | 63,05 | ||||
| Ti+O2=ТiO2 | -0,001 | 11781,21 | -12,79 | ||||
| 2V+5/2O2=V2O5 | -0,001 | 8071,62 | -7,79 | ||||
| Ni+O=NiO | -0,005 | 3396,40 | -15,45 | ||||
| Ca+1/2O2=CaO | -0,049 | 13999,50 | -689,90 | ||||
| Mg+1/2O2=MgO | 0,000 | 18259,50 | 0,00 | ||||
| 2Cr+3/2O2=Cr2O3 | -0,001 | 7474,62 | -10,88 | ||||
| СН4+2О2=СО2+2Н2О | 0,177 | 209070,75 | 37026,43 | ||||
| Шлакообразование | 13,41 | 469,75 | 6299,02 | Тепловые потери | |||
| Тепло внешних ист. | 99000,00 | ||||||
| Невязка | -0,029% | ||||||
| ИТОГО ПРИХОД | 209585,6 | ИТОГО РАСХОД | 209647,0 |
3. Этапы выполнения лабораторной работы
Процедура по расчету теплового баланса реализована средствами EXCEL, экранная форма представления результатов приведена в Приложении 2.
1. С использованием системы расчета, реализованной в табличном процессоре EXCEL (Приложение 2), для заданного варианта металлургического процесса (Приложение 3) рассчитать тепловой баланс металлургического процесса. Исходные данные для расчетов следует взять из таблиц 3, 8, результатов расчета материального баланса и Приложений 1,4
2. Исследовать влияние состава металлошихты (соотношение лом-чугун), изменения расхода науглероживателей, расхода кислорода и расхода природного газа на приходную статью теплового баланса. Построить зависимости.
3. Исследовать влияние изменения температуры выходных потоков на расходную статью теплового баланса. Построить зависимости.
4. Сделать выводы.
Расчеты выполняются в среде EXCEL. В отчете должны быть представлены результаты выполнения указанных этапов. Отчет следует представить в электронном виде.
1. Рыбенко И.А. Разработка средствами Excel системы расчета металлургических процессов / И.А. Рыбенко, С.П. Мочалов // Известия вузов. Черная металлургия.-2005.-№2.-C.55-58
2. Шендриков А.Е. Разработка математического и программного обеспечения инструментальной системы моделирования стационарных режимов металлургических объектов. / А.Е. Шендриков, С.П. Мочалов, И.А. Рыбенко // Системы автоматизации в образовании, науке и призводстве: Сб. науч. тр. труды VI Всерос. научной конференции.-Новокузнецк, 2007.-C.418-422
ПРИЛОЖЕНИЕ 1
Исходные данные для расчетов энтальпии вещества
| Вещество | T | C0 | C-2 | C1 | C2 | C3 | DHф.п. |
| Fecr,l | 298-800 | -6,749 | 0,004419 | 1371,93 | -19058,6 | 4,506003 | |
| 800-1042 | -38217,4 | 29,01968 | 876811,6 | -7531953 | 3,97E-05 | ||
| 1042-1184 | -33783,8 | 73,23172 | 396095,1 | -1305186 | 0,000518 | ||
| 1184-1665 | 24,267 | 82,84 | 0,90132 | ||||
| 1665-1809 | 24,393 | 100,42 | 0,840503 | ||||
| 1809-5000 | 13,80063 | ||||||
| Mncr,l | 298-1000 | 110,881 | -0,02502 | -2780,83 | 33478,9 | -124981 | 4,979002 |
| 1000-1360 | 44,206 | -0,04597 | -18,85 | 2,200085 | |||
| 1360-1410 | 2,200385 | ||||||
| 1410-1517 | 1,900009 | ||||||
| 1517-5000 | 14,09999 | ||||||
| Ticr,l | 298-900 | 40.561 | -0.00442 | -609.62 | 10057.2 | -48849 | 4.824004 |
| 900-1156 | 154.435 | -2027.76 | 1.58E-05 | ||||
| 1156-1944 | 16.908 | 58.84 | 319.2 | 3.800282 | |||
| 1944-5600 | 46.8 | 14.60063 | |||||
| TiCcr,l | 298-3054 | 49.624 | -0.014374 | 31.43 | -174.8 | 4.682002 | |
| Crcr,l | 298-311.5 | 14.55 | 301.87 | 4.049998 | |||
| 311,5-400 | 19.032 | 151.25 | 0.001914 | ||||
| 400-2180 | 31.916 | -0.004174 | -199.12 | 2540.8 | -5075 | 0.000475 | |
| 2180-4700 | 21.30088 | ||||||
| Vcr,l | 298-2220 | 25.806 | -0.001676 | 9.09 | 324.5 | 4.5800012 | |
| 2220-5400 | 45.6 | 22.999986 | |||||
| Nicr,l | 298-631 | 5.156 | -0.000339 | 1378.23 | -29974.8 | 4.785999 | |
| 631-700 | -59386.522 | 44.52345 | 1180668.93 | -6595086 | -0.000467 | ||
| 700-1728 | 21.414 | 0.013144 | 96.78 | 0.0013678 | |||
| 1728-4700 | 17.150279 | ||||||
| Ccr,l | 298-1600 | 0,849 | -0,00179 | 386,43 | -2177,5 | 1,050002 | |
| 1600-5000 | 27,852 | -0,03967 | -28,88 | 6,43E-05 | |||
| Sicr,l | 298-1690 | 23,698 | -0,00435 | 33,05 | 3,217003 | ||
| 1690-5500 | 27,2 | 50,21001 | |||||
| Scr,l | 298-368,3 | 11,007 | 530,58 | -4652,6 | 4,412 | ||
| 368,3-388,36 | 17,318 | 202,43 | 0,401338 | ||||
| 388- 36428,15 | 19762,43 | -5,29348 | -655855 | 1,722064 | |||
| 328,15-432,25 | 57607,27 | -2706087 | 0,000822 | ||||
| 432,25-453,15 | 1371,849 | -56900,7 | 608281,9 | 0,000526 | |||
| 453,15-717 | -202,958 | 0,164044 | 5063,83 | -31130,1 | 0,00012 | ||
| 717-1300 | 0,000469 | ||||||
| Sg | 298-1500 | 26,93941 | -0,0004 | -117,133 | 835,9468 | -2071,06 | 6,657315 |
| 1500-6000 | 15,94493 | 0,041393 | 27,58323 | -33,0274 | 11,0618 | 0,000861 | |
| Pcr,l | 298-317,3 | 69.533 | -3191 | 5.360001 | |||
| 317,3-900 | 26.12 | 0.658998 | |||||
| Pg | 298-1500 | 20.67527 | 3.008443 | 3.755454 | -44.2019 | 173.19 | 6.197353 |
| 1500-6000 | 17.29631 | 0.058213 | -11.4296 | 147.1718 | -155.534 | 0.007283 | |
| Alсr,l | 298-933,61 | 18.781 | -0.00067 | 308.43 | -4277.1 | 4.54 | |
| 933,61-4500 | 31.75 | 10.70019 | |||||
| FeOcr,l | 298-1650 | 58.68 | -0.00646 | -92.92 | 9.700007 | ||
| 1650-4000 | 68.2 | 24.00068 | |||||
| Fe2O3cr,l | 298-955 | -27.583 | 0.00654 | 6360.1 | -87435.1 | 15.56 | |
| 955-1050 | 580.047 | -4187.05 | 0.00065 | ||||
| 1050-1812 | 132.675 | 73.64 | 0.000956 | ||||
| 1812-4000 | 87.00079 | ||||||
| SiO2cr,l | 298-848 | -220.893 | 0.042547 | 11589.09 | -170254 | 6.916001 | |
| 848-1200 | 58.422 | 0.001927 | 103.26 | 0.410892 | |||
| 1200-1996 | 77.583 | -0.04454 | -60.75 | 277.7 | 2.260807 | ||
| 1996-4700 | 83.5 | 9.600019 | |||||
| MnOcr,l | 298-2120 | 47,364 | -0,00474 | 71,99 | 8.913962 | ||
| 2120-5000 | 40.00091 | ||||||
| MnO2cr,l | 298-2000 | 60.491 | -0.011294 | 234.26 | 8.7840077 | ||
| CaOcr,l | 298-3172 | 59.65 | -0.01213 | -162.96 | 1073.5 | -1727 | 6.750004 |
| 3172-6000 | 80.00069 | ||||||
| MgOcr,l | 298-3100 | 45.816 | -0.00972 | 90.29 | -404.6 | 5.159998 | |
| 3100-5100 | 77.0009 | ||||||
| Al2O3cr,l | 298-500 | 97.056 | -0.02636 | 390.2 | 10.01604 | ||
| 500-1200 | 122.679 | -0.05024 | 68.78 | 0.00059 | |||
| 1200-2327 | 107.571 | 165.69 | 7.02E-05 | ||||
| 2327-5400 | 162.9 | 111.4004 | |||||
| CaScr,l | 298-2800 | 46.29 | -0.00119 | 83.7 | 9.009994 | ||
| 2800-5500 | |||||||
| P2O5cr,l | 298-699 | 45.413 | 6716.6 | -33860 | 34.22003 | ||
| 699-1100 | 20.99997 | ||||||
| P2O5g | 298-1500 | 83.31628 | -0.009 | 1357.373 | -9443.2 | 23322.49 | 22.04948 |
| 1500-6000 | 156.8662 | -0.10928 | 5.496079 | -10.1208 | 6.504252 | 0.008096 | |
| NiOcr,l | 298-523 | -1.381 | 0.007913 | 1233.58 | 6.719997 | ||
| 523-560 | -25922.9 | 14.350659 | 601251.43 | -3912924 | 0.0001582 | ||
| 560-2228 | 47.919 | 78.23 | 0.0009956 | ||||
| 2228-4000 | 42.000139 | ||||||
| TiO2cr,l | 228-2185 | 63.196 | -0.010347 | 118.2 | 8.6799944 | ||
| 2185-5000 | 67.99998 | ||||||
| V2O3cr,l | 144.31 | -0.03445 | -186.63 | 1089.2 | 17.13001 | ||
| 139.9999 | |||||||
| Cr2O3cr,l | 298-306 | 1926.054 | -128419.8 | 15.300011 | |||
| 306-310 | 55756.40 | -3578366 | 0.0002914 | ||||
| 310-335 | 2031.709 | -116357.0 | 0.0009726 | ||||
| 335-2705 | 134.44 | -0.028398 | -126.2 | 843.8 | 0.0002350 | ||
| COg | 298-1500 | 24.11842 | 0.0017234 | 108.26640 | -123.674 | -731.052 | 8.6714303 |
| 1500-10000 | 31.44282 | -0.00327 | 36.534980 | -72.6192 | 51.92032 | 0.0037406 | |
| CO2g | 298-1500 | 26.202198029 | -0.0016977 | 511.61584 | -2905.816 | 6200.4462891 | 9.3655181 |
| 1500-6000 | 56.813194275 | -0.0617610 | 42.189521 | -104.6401 | 104.1256 | 0.0012803 | |
| H2g | 298-1500 | 33.10954 | -0.0015978 | -115.1371 | 1161.431 | -2846.12 | 8.4677277 |
| H2Og | 1500-6000 | 31.35982 | -0.0531235 | 21.533424 | 1.857152 | -12.8388 | -0.004309 |
| O2g | 298-1500 | 20.1541 | 0.0020625619218 | 280.73065 | -1771.30 | 4170.090 | 8.6801608 |
| 1500-6000 | 30.38852 | 0.0132984 | 44.142974 | -48.4196 | 20.70430 | 0.0017834 | |
| N2g | 298-1500 | 25.893569946 | 0.0012939 | 51.454040 | 346.88287354 | -1974.94 | 8.6701839 |
| 1500-6000 | 34.686431885 | -0.0386712 | 16.870849 | -33.3948 | 26.49300 | -0.002386 |
ПРИЛОЖЕНИЕ 2
ПРИЛОЖЕНИЕ 3
Варианты заданий для расчета теплового баланса
| № варианта | ||||||||||||||||||||
| Металлошихта | ||||||||||||||||||||
| 1. Жидкий чугун | 25,0 | 40,0 | 50,0 | 10,0 | 20,0 | 25,0 | 20,0 | 30,0 | 30,0 | 35,0 | 20,0 | 25,0 | 25,0 | 35,0 | 20,0 | 30,0 | 10,0 | 50,0 | 50,0 | 40,00 |
| 2. Чушковый чугун | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| 3. Мет. лом | 95,0 | 80,0 | 70,0 | 90,0 | 80,0 | 90,0 | 90,0 | 80,0 | 80,0 | 75,0 | 90,0 | 90,0 | 85,0 | 85,0 | 80,0 | 80,0 | 50,0 | 70,0 | 80,00 | |
| 4. Металлодобавки | 5,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 10,0 | 10,0 | 10,0 | 5,00 | 5,00 | 0,00 | 0,00 | 0,00 | 10,0 | 10,0 | 10,0 | 10,0 | 0,00 |
| Твердые окислители | ||||||||||||||||||||
| 1. Агломерат | 1,50 | 1,50 | 3,00 | 0,00 | 0,00 | 1,00 | 1,50 | 2,00 | 1,50 | 2,00 | 1,50 | 2,00 | 1,50 | 2,00 | 2,50 | 2,50 | 0,60 | 2,50 | 1,20 | 1,70 |
| 2. Железная руда | 2,50 | 2,50 | 1,50 | 1,50 | 1,50 | 1,00 | 0,30 | 0,50 | 0,40 | 0,30 | 0,50 | 0,00 | 1,40 | 1,10 | 0,50 | 0,60 | 0,60 | 0,40 | 0,20 | 0,10 |
| 3. Окатыши | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,10 | 0,20 | 0,00 | 0,10 | 0,80 | 0,00 | 0,50 | 0,10 | 0,00 | 0,00 | 0,50 | 0,30 | 0,10 |
| 4. Окалина | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,50 | 0,10 | 0,10 | 0,15 | 0,40 | 0,00 | 1,00 | 0,00 | 0,00 | 0,00 | 0,10 | 0,30 | 0,10 | 0,20 | 0,10 |
| Шлакообразующие | ||||||||||||||||||||
| 1. Известь | 6,20 | 5,50 | 5,50 | 6,00 | 5,00 | 6,00 | 5,40 | 6,20 | 6,10 | 5,80 | 6,30 | 7,00 | 5,40 | 6,60 | 5,90 | 6,00 | 5,00 | 5,90 | 6,00 | 5,80 |
| 2. Известняк | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,20 | 0,30 | 0,00 | 0,00 | 1,00 | 0,20 | 0,00 | 0,10 | 0,00 | 1,00 | 0,30 | 0,20 | 0,30 |
| 3. Плавиковый шпат | 0,50 | 0,10 | 0,50 | 0,10 | 0,20 | 0,00 | 1,00 | 0,00 | 0,10 | 0,50 | 0,30 | 0,50 | 0,00 | 0,00 | 0,50 | 0,00 | 0,50 | 0,20 | 0,10 | 0,30 |
| 4. Кварцит | 0,30 | 0,30 | 0,25 | 0,20 | 0,50 | 0,20 | 0,10 | 0,00 | 0,50 | 0,10 | 0,20 | 0,10 | 0,00 | 0,20 | 0,10 | 0,40 | 0,50 | 0,20 | 0,50 | 0,30 |
| 5. Боксит | 0,40 | 0,45 | 0,00 | 0,00 | 0,00 | 0,50 | 0,00 | 0,00 | 1,00 | 0,20 | 0,10 | 0,30 | 0,50 | 0,20 | 0,50 |
 2015-06-24
2015-06-24 3398
3398