Балансы ХТС составляются для всей ХТС, отдельных ее элементов или групп элементов (рис. 4.19). Выделение отдельных элементов или групп элементов ХТС со следующим составлением их балансов дает информацию не только об эффективности ХТС в целом, но и о ее составных, что дает возможность проявить "узкие места" ХТС, изменять технологические параметры работы отдельных элементов или их совокупности и направлено интенсифицировать ХТС.
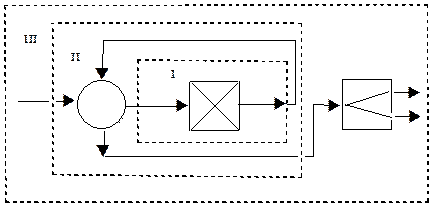
Рис. 19. Схема выделения в ХГС технологических узлов для составления балансов: І - один элемент; II - группа элементов; III - ХТС в целом
Материальный баланс является выражением закона сохранения массы вещества, согласно которому в любой замкнутой системе масса веществ, которые приняли участие в реакции, равняется массе веществ, образованных вследствие этого взаимодействия. Относительно любой ХТС это означает, что масса веществ, которая поступила на технологическую операцию - приход, равняется массе полученных веществ - расход. Материальный баланс составляют по уравнениям основной суммарной реакции, параллельных и побочных реакций с учетом степеней превращения, селективности и т.п.. В производственных процессах даже между основными компонентами сырья, кроме основной, проходят побочные реакции; кроме того, побочные реакции предопределяются присутствием в исходном сырье примесей. Преимущественно учитывают не все реакции, которые проходят, а лишь те, которые имеют решающее значение, т.е. материальный баланс является в некоторой мере приблизительным. Поэтому допускается разность между приходом и расходом в пределах 3 %. Поскольку практически приходится иметь дело не с чистыми веществами, а с сырьем, которое содержит много компонентов и примесей, то приходится составлять балансы по массам основных компонентов и примесей во всех видах исходного сырья и массами основного продукта, побочных продуктов и отходов производства. Итак, при составлении материального баланса учитывают все вещества, независимо от того или они принимают участие в химических реакциях, или являются инертными в этих условиях. Это необходимо потому, что на основании данных материального баланса выполняют тепловые расчеты процесса - составляют тепловой баланс. Данные обеих балансов дальше используют для выполнения конструктивно- технологических расчетов оборудования (рабочих объемов аппаратов, их геометрических размеров, диаметров штуцеров, площади теплообменных поверхностей, объемов сепарационных пространств и т.п.).
Пример. Пусть в процесс поступают вещества, массы которых равны 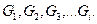 Вследствие химического взаимодействия получают продукты с массами
Вследствие химического взаимодействия получают продукты с массами 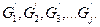 Уравнение материального баланса такой системы запишется так:
Уравнение материального баланса такой системы запишется так:
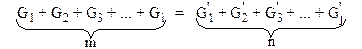
или в общем виде
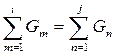 (20)
(20)
или
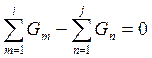 (21)
(21)
Масса основного продукта преимущественно задается или измеряется в действующем производстве. Из уравнений материального баланса определяют массу нужного сырья или побочных продуктов, которую невозможно измерить в существующем производстве или задать заведомо. Материальный баланс преимущественно составляют в расчете расхода сырья и получения побочных продуктов на единицу (тонну, килограмм, кмоль) основного продукта; иногда балансы составляют на единицу массы сырья или на единицу времени (час, сутки, месяц). Из составленных материальных балансов находят расходные коэффициенты по сырью, выход продуктов, степени превращения компонентов сырья, селективность процесса. В простейшем случае составляют материальный баланс по одному из исходных веществ или же по целевому продукту R.
Энергетический баланс составляется на основании закона сохранения энергии согласно которому в замкнутой системе энергия не уничтожается, а лишь превращается из одного вида в другой. Обычно в ХТС составляется тепловой баланс, относительно которого закон сохранения энергии формулируется так приход теплоты в определенном технологическом процессе (Qприх) равняется ее расходу в этом самом процессе (Qрасх). Тепловой баланс составляют по данным материального баланса и тепловых эффектов химических реакций и физических превращений, учитывая подвод теплоты извне и отвод ее с продуктами реакции хладагентом, а также через стенки аппарата.
Поэтому
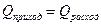 (22)
(22)
или
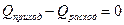 (23)
(23)
При этом в уравнение теплового баланса входят такие величины: Приход:
а) теплота, которая вносится в аппарат (реактора) с начальными реагентами - Q1;
б) теплота, которая вносится в аппарат инертными веществами, которые не берут непосредственного участия в химической реакции (например, азот воздуха, который используют для процессов окисления, выжигания; дымовые газы, которые служат для нагревания реакционной системы и т.п.) –Q2;
в) теплота экзотермических химических реакций –Q3;
г) теплота экзотермических физических процессов (кристаллизации, растворения с выделением теплоты, конденсации и т.п.) –Q4
д) теплота, которая передается от нагревательных элементов Q 5.
Расход:
е) теплота, которая выносится из аппарата продуктами реакции- 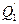 ;
;
ж) теплота эндотермических химических реакций- 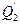 ;
;
з) теплота эндотермических физических процессов (плавление, растворение с поглощением теплоты, выпаривание и т.п.) - 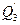 ;
;
и) теплота, которая отводится хладагентом - 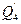 ;
;
к) потери теплоты у окружающей среду - 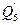 .
.
Итак, уравнение теплового баланса приобретает такой вид:
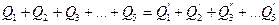 (24)
(24)
или в общем виде 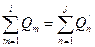 (25)
(25)
или 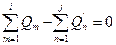 (26)
(26)
Теплота Q1, которая вносится в аппарат с исходными реагентами, рассчитывается по уравнению
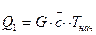 (27)
(27)
где G- масса продуктов, которые поступают в процесс (кг, г, кмоль или кг/ч, м3/ч, кмоль/ч); эту величину получают из данных материального баланса, который рассчитывается ранее теплового баланса, 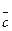 - средняя теплоемкость продуктов при температуре Тнач; Тнач - температура продуктов, которые поступают в процесс, °С.
- средняя теплоемкость продуктов при температуре Тнач; Тнач - температура продуктов, которые поступают в процесс, °С.
Величина 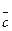 должна выбираться или рассчитываться соответственно размерности величины G: если Gвыражается в кг или кг/ч, то
должна выбираться или рассчитываться соответственно размерности величины G: если Gвыражается в кг или кг/ч, то 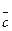 — в кДж/(кг град); если Gвыражается в м3 или м3/ч, то
— в кДж/(кг град); если Gвыражается в м3 или м3/ч, то 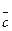 - в кДж/(м3 град) и т.п..
- в кДж/(м3 град) и т.п..
Преимущественно в расчетах приходится иметь дело не с чистыми веществами, а с их смесями. Теплоемкость смесей почти всегда неизвестна, поскольку таблицы специальных справочников содержат значение теплоемкости лишь чистых веществ. Поэтому в случае расчета величины Q1для продуктов, которые состоят из нескольких компонентов, формула (27) приобретает такой вид:
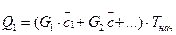 (28)
(28)
где G1, G2 ,... - масса соответствующего компонента в смеси; G = G1+G2+...; 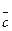 средние теплоемкости компонентов смеси.
средние теплоемкости компонентов смеси.
Теплота Q2, которая вносится с веществами, которые не берут непосредственного участия в химической реакции (например, с дымовыми газами, паром и т.п.), рассчитывается по потере теплоты теплоносителем
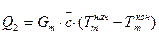 (29)
(29)
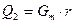 (30)
(30)
или же по формуле теплопередачи через греющую стенку
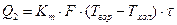 (30)
(30)
где Gm - масса теплоносителя; 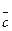 - его средняя теплоемкость;
- его средняя теплоемкость; 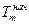 и
и 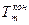 - его
- его
начальная и конечная температуры; r - теплота испарения; Кт - коэффициент теплопередачи; F- поверхность теплопередачи; Тгор - средняя температура теплоагента (дымовых газов, пара и т.п.); Тхол - средняя температура веществ, которые нагреваю тся; т- время нагревания.
Аналогично по формуле теплопередачи можно рассчитать отвод теплоты от реакционной массы 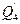 .
.
Теплоты химических и физических преобразований 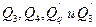 могут
могут
охватывать несколько величин, в зависимости от того, какие превращения происходят в конкретном процессе.
Значение тепловых величин (тепловой эффект реакции, теплота растворения и т.п.) берутся из специальных таблиц и диаграмм (например, [10,11]). Тепловой эффект реакции можно рассчитать также по закону Гесса
Согласно закону Гесса тепловой эффект изобарного химического превращения не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы.
Большинство технологических процессов проходит при постоянном давлении, поэтому тепловой эффект реакции равняется изменению энтальпии ∆ Н(с противоположным знаком). Тепловой эффект изобарной реакции можно рассчитать на основании закона Гесса как разность энтальпий конечных продуктов и исходных веществ. Например, для модельной реакции
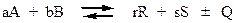 (31)
(31)
тепловой эффект запишется так
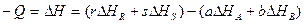 (32)
(32)
где 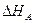 ,
, 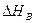 ,
, 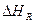 ,
, 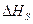 - теплоты образования (энтальпии) веществ А,В,R,S при стандартных условиях.
- теплоты образования (энтальпии) веществ А,В,R,S при стандартных условиях.
Необходимые данные для этого расчета содержатся в таблицах справочных пособий, например, [1-2]. В этих таблицах приводятся свойства чистых веществ при стандартных условиях, а именно: мольная теплоемкость 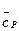 ), энтальпия (
), энтальпия (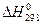 ), энтропия (
), энтропия (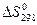 )и прочие. Стандартными условиями считаются температура 298 К и давление 1,013-105 Па. Условно считают, что теплоты образования (энтальпия
)и прочие. Стандартными условиями считаются температура 298 К и давление 1,013-105 Па. Условно считают, что теплоты образования (энтальпия 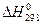 ) простых веществ равняют нулю.
) простых веществ равняют нулю.
Кроме того, тепловой эффект реакции можно определить на основании почленного суммирования уравнений и тепловых эффектов разных реакций (например, сгорание) так, чтобы вследствие этого получить нужное уравнение.
Однако найденная теплота реакции касается стандартных условий. Большинство химических реакций проходят при разных температурах. Поэтому в случае выполнения технологических расчетов следует учитывать зависимость теплового эффекта от температуры. Эта зависимость является математическим выражением закона Кирхгоффа и имеет такой вид:
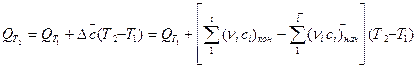 (33)
(33)
где 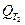 и
и 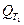 -тепловой эффект реакции за температур Т2 и Т1, соответственно; значение
-тепловой эффект реакции за температур Т2 и Т1, соответственно; значение 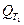 берется при стандартных условиях (найденное по закону Гесса), поэтому Т1=298 К;
берется при стандартных условиях (найденное по закону Гесса), поэтому Т1=298 К; 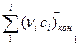 и
и 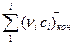 - сумма средних теплоемкостей конечных продуктов реакции и начальных реагентов соответственно; νi, - стехиометрические коэффициенты в уравнении реакции.
- сумма средних теплоемкостей конечных продуктов реакции и начальных реагентов соответственно; νi, - стехиометрические коэффициенты в уравнении реакции.
Для более точных расчетов следует принимать во внимание, что теплоемкость компонентов системы зависит от температуры и описывается эмпирическим уравнением
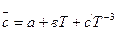 (34)
(34)
где а, в и с ' - коэффициенты, которые зависят от природы вещества и значение которых приведены в справочной литературе, например, [10-11]. Тогда можно записать
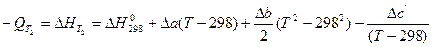 (35)
(35)
При этом обязательно нужно иметь в виду, что найденный или рассчитанный тепловой эффект реакции преимущественно выражается в кДж на 1 моль исходного реагента или продукта реакции, а в статьях теплового баланса количество теплоты приводится в кДж/ч или кДж. Поэтому необходимо выполнить перерасчет теплоты
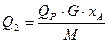 (36)
(36)
где G - масса реагента, кг или кг/ч; М- его мольная масса, кг/кмоль; хА - степень превращения.
Тепловые потери у окружающей среду Q '5 принимают на основании практических данных или определяют как разность между (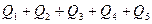 )и (
)и ( 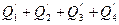 ).
).
Балансы могут оформляться в виде сводных таблиц, в левой части которых приводятся, а потом подытоживаются все статьи прихода, а в правой части - все статьи расхода. В качестве примера, ниже приводятся таблицы материального и теплового балансов контактного аппарата для окисления аммиака в производстве азотной кислоты (табл. 1, 2).
Преимуществами изображения балансов в форме таблиц является их простота, наглядность, возможность контролировать результаты и использовать их для определения показателей процесса.
Таблица 1 Материальный баланс контактного аппарата
| Приход | Расход | ||||
| Статья | кг/ч | % | Статья | кг/ч | % |
| 1. Аммиак | 1573,6 | 6,9 | 1. Нитрозные газы, в т.ч. NO O2 N2 Пары воды | 22797,6 | 11,9 5,0 69,4 13,7 |
| 2. Воздух, в т.ч. Кислород Азот Пары воды | 21224,0 4801,2 15805,0 617,8 | 93,1 21,1 69,3 2,7 | |||
| Итого | 22797,6 | Итого | 22797,6 |
Таблица 2. Тепловойбаланс контактного аппарата
| Приход | Расход | ||||
| Статья | кДж/ч | % | Статья | кДж/ч | % |
| 1. С аммиачно-воздушной смесью | 7, 6 | 1. С нитрозными газами | 98,0 | ||
| 2. Теплота химических реакций, в т.ч. основной побочной | 92,4 89,2 3,2 | 2. Потери в окружающую | 2,0 | ||
| Итого | Итого |
Для быстрого обзора результатов баланса для отдельных элементов ХТС удобно нанести на блочную схему значения материальных или тепловых потоков. Например, на рис. 4.20 изображено в виде блоков два элемента технологической схемы окисления аммиака - контактный аппарат и котел-утилизатор, с нанесенными значениями величин материального баланса этих элементов.
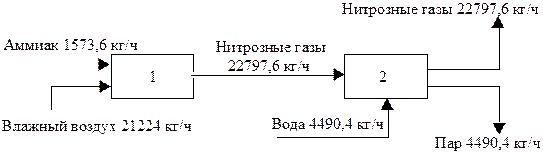
Рис.20. Блок-схема контактного узла окисления аммиака: 1 - контактный аппарат; 2 - котел-утилизатор
Другим способом является графическое изображение результатов балансов в виде диаграмм разнообразного произвольного вида, которые наглядно воссоздают соотношение между отдельными статьями прихода и затраты (рис. 21).
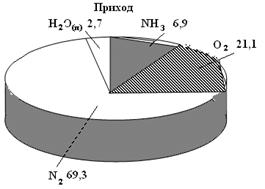
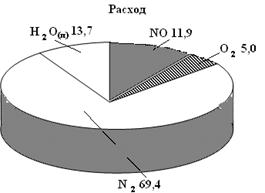
Рис.21. Диаграмма результатов материального баланса (%) контактного аппарата окисления аммиака
Результаты балансов дают возможность рассчитать коэффициенты затраты сырья и энергетических ресурсов, состав и качество полученных продуктов, выход продуктов, селективность, материальные и энергетические потери, степень превращения сырья и степень использования энергии.
Степень использования энергии характеризуется энергетическим коэффициентом полезного действия (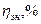 %), который равняется отношению количества энергии, которую надо израсходовать теоретически для получения единицы массы продукта (Wm), к количеству практически израсходованной энергии (Wпр)
%), который равняется отношению количества энергии, которую надо израсходовать теоретически для получения единицы массы продукта (Wm), к количеству практически израсходованной энергии (Wпр)
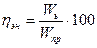 (37)
(37)
Частным случаем энергетического КПД естьтепловой КПД под которым понимают отношение количества полезно израсходованной теплоты (Qпол)(например, на осуществление целевой реакции) к общей затрате теплоты в процессе (Qобщ )
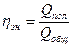 (38)
(38)
Тепловой КПД, как правило, имеет невысокое значение и обычно не превышает 70 %. До 30 % теплоты (а иногда и больше) выносится с отходящими продуктами и до 15 % представляют потери через стенки реактора в окружающую среду.
Теплота продуктов реакции может быть использована для предварительного нагревания реагентов, которые поступают в реактор (например, во внешнем теплообменнике или регенераторе), или для производства водяного пара в котлах-утилизаторах. Эти мероприятия практически воплощаются в энерготехнологических схемах.
Тепловые потери уменьшают тепловой изоляцией аппарата и выбором таких его габаритов, которые обеспечивают наименьшую поверхность теплоотдачи в окружающую среду. Следует заметить, что некоторые реакторы теплоизолировать нельзя из-за специфических условий работы. Например, вращающиеся барабанные печи для выжигания клинкера работают при температуре 1200...1400 °С, поэтому при отсутствии естественного охлаждения извне их корпус может деформироваться. Вот почему тепловые потери в окружающую среду этих аппаратов составляют близко 25 %.
Однако энергетический КПД, который определяют на основании данных теплового (энтальпийного) баланса, не дает возможности в полной мере оценить эффективность процесса, поскольку он не всегда учитывает потенциальные возможности системы, т.е. способность использовать ее внутренний запас энергии. Задача минимизации затрат энергии в химико-технологическом процессе, определение степени его термодинамического совершенства, а также пригодности энергии превращаться в другие формы можно решить, используя э ксергетический метод, который является сравнительно новым методом химической термодинамики.
 2015-01-07
2015-01-07 10215
10215
